Antibakteriell behandling: Bactrim 400/80mg, 800/160mg Trimethoprim Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Märke: Bactrim
Generiskt namn: sulfametoxazol och trimetoprim injektion för intravenös infusion
Vad är Bactrim 800mg?
Bactrim (sulfametoxazol och trimetoprim) DS är en kombination av två antibiotika som används för att behandla urinvägsinfektioner, akut otitis media, bronkit, Shigellosis, Pneumocystis pneumoni, resenärsdiarré, meticillinresistent Staphylococcus aureus och andra bakterier (MRSA), infektioner som är mottagliga för detta antibiotikum.
Vilka är biverkningar av Bactrim?
Vanliga biverkningar av Bactrim inkluderar:
- aptitlöshet,
- illamående,
- kräkningar,
- smärtsam eller svullen tunga,
- yrsel,
- snurrande känsla,
- ringer i dina öron,
- trötthet, eller
- sömnproblem (sömnlöshet).
Tala om för din läkare om du upplever allvarliga biverkningar av Bactrim 800mg inklusive:
- blåmärken eller blödning,
- aplastisk anemi,
- gulsot,
- levernekros,
- munsår,
- ledvärk,
- svåra hudutslag,
- klåda, och
- öm hals.
BESKRIVNING
BACTRIM™ (trimetoprim och sulfametoxazol) injektion, en steril lösning endast för intravenös infusion, är en kombination av sulfametoxazol, ett sulfonamidantimikrobiellt medel, och trimetoprim, en antibakteriell dihydrofolatreduktashämmare. Varje 5 ml innehåller 80 mg trimetoprim (16 mg/ml) och 400 mg sulfametoxazol (80 mg/ml) blandat med 40 % propylenglykol, 10 % etylalkohol och 0,3 % dietanolamin; 1 % bensylalkohol och 0,1 % natriummetabisulfit tillsatt som konserveringsmedel, vatten för injektion och pH justerat till cirka 10 med natriumhydroxid.
Trimetoprim är 2,4-diamino-5-(3,4,5-trimetoxibensyl)pyrimidin. Det är en vit till ljusgul, luktfri, bitter förening med en molekylvikt på 290,3 och följande strukturformel:
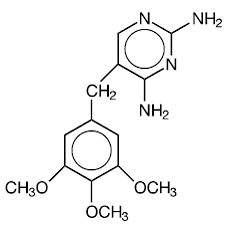
C14H18N4O3 MW 290,3
Sulfametoxazol är N1-(5-metyl-3-isoxazolyl)sulfanilamid. Det är en nästan vit, luktfri, smaklös förening med en molekylvikt på 253,28 och följande strukturformel:
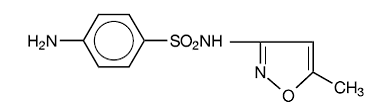
C10H11N3O3S MW 253,28
INDIKATIONER
Pneumocystis jirovecii Lunginflammation
BACTRIM är indicerat för behandling av Pneumocystis jirovecii pneumoni hos vuxna och pediatriska patienter som är två månader gamla och äldre.
Shigellos
BACTRIM 400 mg är indicerat för behandling av enterit orsakad av känsliga stammar av Shigella flexneri och Shigella sonnei hos vuxna och pediatriska patienter som är två månader gamla och äldre.
Urinvägsinfektion
BACTRIM är indicerat för behandling av svåra eller komplicerade urinvägsinfektioner hos vuxna och pediatriska patienter som är två månader gamla och äldre på grund av känsliga stammar av Escherichia coli, Klebsiella-arter, Enterobacter-arter, Morganella morganii, Proteus mirabilis och Proteus vulgaris vid oral administrering av BACTRIM är inte genomförbart och när organismen inte är mottaglig för antibakteriella medel som är effektiva i urinvägarna.
Användande
För att minska utvecklingen av läkemedelsresistenta bakterier och bibehålla effektiviteten hos BACTRIM och andra antibakteriella läkemedel, ska BACTRIM endast användas för att behandla eller förebygga infektioner som är bevisade eller starkt misstänkta orsakas av känsliga bakterier. När information om odling och känslighet finns tillgänglig bör de övervägas vid val eller modifiering av antibakteriell terapi. I avsaknad av sådana data kan lokal epidemiologi och känslighetsmönster bidra till empiriskt urval av terapi.
Även om lämpliga odlings- och känslighetsstudier bör utföras, kan behandling påbörjas i avvaktan på resultaten av dessa studier.
DOSERING OCH ADMINISTRERING
Dosering hos vuxna och pediatriska patienter (två månaders ålder och äldre)
Den maximala rekommenderade dagliga dosen är 60 ml (960 mg trimetoprim) per dag.
Dosändringar hos patienter med nedsatt njurfunktion
När njurfunktionen är nedsatt ska en reducerad dos användas, som visas i Tabell 2.
Viktiga administrationsinstruktioner
Administrera lösningen genom intravenös infusion under en period av 60 till 90 minuter. Undvik administrering genom snabb infusion eller bolusinjektion. Administrera INTE BACTRIM 400 mg intramuskulärt.
Inspektera visuellt parenterala läkemedelsprodukter för partiklar och missfärgning före administrering, närhelst lösningen och behållaren tillåter.
Metod för beredning
Utspädning av injektionsflaskor med enkel- och flerdos
BACTRIM måste spädas. Varje 5 mL ska tillsättas till 125 mL 5 % dextros i vatten. Efter spädning med 5 % dextros i vatten ska lösningen inte kylas och användas inom 6 timmar.
Om en utspädning av 5 ml per 100 ml 5 % dextros i vatten önskas, bör den användas inom 4 timmar. I de fall där vätskerestriktion är önskvärd, kan varje 5 ml tillsättas till 75 ml 5% dextros i vatten. Under dessa omständigheter ska lösningen blandas strax före användning och ska administreras inom 2 timmar.
Om det vid visuell inspektion finns grumlighet eller tecken på kristallisation efter blandning, ska lösningen kasseras och en ny lösning beredas.
Do INTE blanda Bactrim i 5 % dextros i vatten med läkemedel eller lösningar i samma behållare.
Flerdosflaskor (hantering)
Efter första införandet i injektionsflaskan måste det återstående innehållet användas inom 48 timmar.
Infusionssystem för intravenös administrering
Följande infusionssystem har testats och befunnits vara tillfredsställande: enhetsdosglasbehållare; endosbehållare av polyvinylklorid och polyolefin. Inga andra system har testats och därför kan inga andra rekommenderas.
HUR LEVERERAS
Doseringsformer och styrkor
BACTRIM finns tillgängligt som en injektion innehållande 80 mg/ml sulfametoxazol och 16 mg/ml trimetoprim i 10 ml enkeldos- och 30 ml flerdosflaskor.
Förvaring Och Hantering
BACTRIM™ (sulfametoxazol och trimetoprim) injektion levereras enligt följande:
10 ml injektionsflaskor innehållande 160 mg trimetoprim (16 mg/ml) och 800 mg sulfametoxazol (80 mg/ml) för infusion med 5 % dextros i vatten.
10 ml injektionsflaska: NDC 49708-001-4210 ml injektionsflaska (kartong med 10): NDC 49708-001-45
30 ml flerdosflaskor vardera 5 ml innehållande 80 mg trimetoprim (16 mg/ml) och 400 mg sulfametoxazol (80 mg/ml) för infusion med 5 % dextros i vatten.
30 ml injektionsflaska (kartong med 1): NDC 49708-002-47
Förvara i rumstemperatur (15°C – 30°C eller 59°F – 86°F). KYL INTE.
REFERENSER
1. Winston DJ, Lau WK, Gale RP, Young LS. Trimetoprim-sulfametoxazol för behandling av Pneumocystis carinii lunginflammation. Ann Intern Med. juni 1980;92:762-769.
Distribuerat av: Sun Pharmaceutical Industries, Inc. Cranbury, NJ 08512. Reviderad: juli 2020
BIEFFEKTER
Följande allvarliga biverkningar beskrivs på andra ställen i märkningen:
- Embryo-fetal toxicitet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Överkänslighet och andra dödliga reaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Trombocytopeni [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Clostridioides difficile-associerad diarré [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Sulfitkänslighet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Risk förknippad med samtidig användning av Leucovorin för Pneumocystis jirovecii lunginflammation [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Propylenglykoltoxicitet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , NEGATIVA REAKTIONER ]
- Infusionsreaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hypoglykemi [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Elektrolytavvikelser [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
De vanligaste biverkningarna är gastrointestinala störningar (illamående, kräkningar och anorexi) och allergiska hudreaktioner (såsom hudutslag och urtikaria).
Lokal reaktion, smärta och lätt irritation vid intravenös (IV) administrering är sällsynt. Tromboflebit har observerats.
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats efter användning av BACTRIM efter godkännande. Eftersom dessa reaktioner rapporterades frivilligt från en population av osäker storlek, är det inte möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering:
- Trombotisk trombocytopeni purpura
- Idiopatisk trombocytopen purpura
- QT-förlängning som resulterar i ventrikulär takykardi och torsade de pointes
- Metabolisk acidos
LÄKEMEDELSINTERAKTIONER
Potential för BACTRIM 400mg att påverka andra droger
Trimetoprim är en hämmare av CYP2C8 såväl som OCT2-transportör. Sulfametoxazol är en hämmare av CYP2C9. Undvik samtidig administrering av BACTRIM 80 mg med läkemedel som är substrat för CYP2C8 och 2C9 eller OCT2.
Interaktioner med laboratorie- eller diagnostiska tester
BACTRIM, närmare bestämt trimetoprimkomponenten, kan störa en serummetotrexatanalys som bestäms av den kompetitiva bindningsproteintekniken (CBPA) när ett bakteriellt dihydrofolatreduktas används som bindningsprotein. Ingen störning inträffar dock om metotrexat mäts med en radioimmunoanalys (RIA).
Närvaron av BACTRIM kan också störa Jaffes alkaliska pikratreaktionsanalys för kreatinin, vilket resulterar i överskattningar på cirka 10 % av normala värden.
REFERENSER
2. Al-Khatib SM, LaPointe N, Kramer JM, Califf RM. Vad läkare bör veta om QT-intervallet. JAMA. 2003;289(16):2120-2127.
3. Boyer EW, Stork C, Wang RY. Översyn: Dofetilids farmakologi och toxikologi. Int J Med Toxicol. 2001;4(2):16.
5. London NJ, Garg SJ, Moorthy RS, Cunningham ET. Läkemedelsinducerad uveit. J Oftalmic Inflamm Infect. 2013;3:43.
6. Marinella MA. Trimetoprim-inducerad hyperkalemi: En analys av rapporterade fall. Gerontol. 1999;45:209-212.
7. Margassery S, Bastani B. Livshotande hyperkalemi och acidos sekundärt till behandling med trimetoprimsulfametoxazol. J. Nephrol. 2001;14(5):410-414.
8. Moh R, et al. Hematologiska förändringar hos vuxna som får en zidovudin-innehållande HAART-kur i kombination med cotrimoxazol i Elfenbenskusten. Antivir Ther. 2005;10(5):615-24.
9. Kosoglou T, Rocci ML Jr, Vlasses PH. Trimetoprim förändrar dispositionen av prokainamid och Nacetylprokainamid. Clin Pharmacol Ther. okt 1988;44(4):467-77.
VARNINGAR
Ingår som en del av FÖRSIKTIGHETSÅTGÄRDER sektion.
FÖRSIKTIGHETSÅTGÄRDER
Embryo-fetal toxicitet
Vissa epidemiologiska studier tyder på att exponering för BACTRIM under graviditet kan vara associerad med en ökad risk för medfödda missbildningar, särskilt neuralrörsdefekter, kardiovaskulära missbildningar, urinvägsdefekter, munspalt och klumpfot. Om BACTRIM 400 mg används under graviditet, eller om patienten blir gravid medan du tar detta läkemedel, ska patienten informeras om de potentiella farorna för fostret [se Användning i specifika populationer ].
Överkänslighet och andra dödliga reaktioner
Dödsfall i samband med administrering av sulfonamider har inträffat på grund av allvarliga reaktioner, inklusive Stevens-Johnsons syndrom, toxisk epidermal nekrolys, fulminant levernekros, agranulocytos, aplastisk anemi och andra bloddyskrasier.
Sulfonamider, inklusive produkter som innehåller sulfonamider såsom BACTRIM, ska avbrytas vid första uppkomsten av hudutslag eller tecken på biverkningar. Kliniska tecken, såsom utslag, ont i halsen, feber, artralgi, hosta, andnöd, blekhet, purpura eller gulsot kan vara tidiga tecken på allvarliga reaktioner. Ett hudutslag kan följas av mer allvarliga reaktioner, såsom Stevens-Johnsons syndrom, toxisk epidermal nekrolys, levernekros eller allvarlig blodsjukdom. Fullständiga blodvärden bör göras ofta hos patienter som får sulfonamider. Hosta, andnöd och lunginfiltrat är överkänslighetsreaktioner i luftvägarna som har rapporterats i samband med sulfonamidbehandling.
Trombocytopeni
BACTRIM-inducerad trombocytopeni kan vara en immunmedierad störning. Allvarliga fall av trombocytopeni som är dödlig eller livshotande har rapporterats. Övervaka patienter för hematologisk toxicitet. Trombocytopeni försvinner vanligtvis inom en vecka efter utsättande av BACTRIM.
Streptokockinfektioner och reumatisk feber
Undvik användning av BACTRIM vid behandling av streptokockfaryngit. Kliniska studier har dokumenterat att patienter med grupp A β-hemolytisk streptokock tonsillofaryngit har en högre förekomst av bakteriologisk misslyckande när de behandlas med BACTRIM 800 mg än de patienter som behandlas med penicillin, vilket framgår av misslyckande med att utrota denna organism från tonsillofaryngealområdet. Därför kommer BACTRIM inte att förhindra följdsjukdomar såsom reumatisk feber.
Clostridioides Difficile-associerad diarré
Clostridioides difficile-associerad diarré (CDAD) har rapporterats vid användning av nästan alla antibakteriella medel, inklusive BACTRIM 80 mg, och kan variera i svårighetsgrad från mild diarré till fatal kolit. Behandling med antibakteriella medel förändrar den normala floran i tjocktarmen vilket leder till överväxt av C. difficile.
C. difficile producerar toxiner A och B som bidrar till utvecklingen av CDAD. Hypertoxinproducerande stammar av C. difficile orsakar ökad sjuklighet och mortalitet, eftersom dessa infektioner kan vara motståndskraftiga mot antimikrobiell terapi och kan kräva kolektomi. CDAD måste övervägas hos alla patienter som får diarré efter antibakteriell användning. Noggrann medicinsk historia är nödvändig eftersom CDAD har rapporterats inträffa mer än två månader efter administrering av antibakteriella medel.
Om CDAD misstänks eller bekräftas kan pågående antibakteriell användning som inte är riktad mot C. difficile behöva avbrytas. Lämplig vätske- och elektrolythantering, proteintillskott, antibakteriell behandling av
C. difficile, och kirurgisk utvärdering bör inledas som kliniskt indicerat.
Sulfitkänslighet
BACTRIM 400 mg innehåller natriummetabisulfit, en sulfit som kan orsaka allergiska reaktioner, inklusive anafylaktiska symtom och livshotande eller mindre allvarliga astmatiska episoder hos vissa känsliga personer. Den totala prevalensen av sulfitkänslighet i den allmänna befolkningen är okänd. Sulfitkänslighet ses oftare hos astmatiker än hos icke-astmatiska personer.
Bensylalkoholtoxicitet hos pediatriska patienter ("Gasping Syndrome")
BACTRIM 160mg innehåller bensylalkohol som konserveringsmedel. Allvarliga och dödliga biverkningar inklusive "gasping syndrome" kan förekomma hos nyfödda och lågfödelseviktiga spädbarn som behandlas med bensylalkoholkonserverade formuleringar i infusionslösningar, inklusive BACTRIM. "Giftningssyndromet" kännetecknas av depression i centrala nervsystemet, metabolisk acidos och flämtande andningar. BACTRIM 160 mg är kontraindicerat till pediatriska patienter yngre än två månader [se KONTRAINDIKATIONER ].
När du förskriver BACTRIM 400 mg till pediatriska patienter (två månader gamla och äldre), överväg den kombinerade dagliga metaboliska belastningen av bensylalkohol från alla källor inklusive BACTRIM (innehåller 10 mg bensylalkohol per ml) och andra läkemedel som innehåller bensylalkohol. Den minsta mängd bensylalkohol vid vilken allvarliga biverkningar kan uppstå är inte känd [se Användning i specifika populationer ].
Risk förknippad med samtidig användning av Leucovorin för Pneumocystis jirovecii lunginflammation
Behandlingssvikt och överdödlighet observerades när BACTRIM användes samtidigt med leukovorin för behandling av HIV-positiva patienter med Pneumocystis jirovecii pneumoni i en randomiserad placebokontrollerad studie.4 Undvik samtidig administrering av BACTRIM och leucovorin under behandling av Pneumocystis pneumrovecii.
Propylenglykoltoxicitet
BACTRIM innehåller propylenglykol som lösningsmedel (40 % v/v). Vid administrering i höga doser som för behandling av P. jirovecii pneumoni och samtidigt med andra produkter som innehåller propylenglykol, kan hyperosmolaritet med anjongap metabolisk acidos, inklusive laktacidos, uppstå. Propylenglykoltoxicitet kan leda till akut njurskada, CNS-toxicitet och multiorgansvikt. Övervaka det totala dagliga intaget av propylenglykol från alla källor och för syra-basrubbningar. Avbryt BACTRIM 400mg om propylenglykoltoxicitet misstänks [se NEGATIVA REAKTIONER ].
Folatbrist
Undvik användning av BACTRIM 160 mg till patienter med nedsatt njur- eller leverfunktion, hos patienter med möjlig folatbrist (t.ex. äldre, kroniska alkoholister, patienter som får antikonvulsiv behandling, patienter med malabsorptionssyndrom och patienter i undernäringstillstånd) och hos de med svår allergier eller bronkial astma.
Hematologiska förändringar som tyder på folsyrabrist kan förekomma hos äldre patienter eller hos patienter med redan existerande folsyrabrist eller njursvikt. Dessa effekter är reversibla genom folinsyraterapi [se Användning i specifika populationer ].
Hemolys
Hos individer med brist på glukos-6-fosfatdehydrogenas kan hemolys förekomma. Denna reaktion är ofta dosrelaterad.
Infusionsreaktioner
Lokal irritation och inflammation på grund av extravaskulär infiltration av infusionen har observerats med BACTRIM. Om dessa inträffar ska infusionen avbrytas och återupptas på ett annat ställe.
Hypoglykemi
Fall av hypoglykemi hos icke-diabetespatienter som behandlats med BACTRIM 400 mg har setts, vanligtvis efter några dagars behandling. Patienter med nedsatt njurfunktion, leversjukdom, undernäring eller de som får höga doser BACTRIM 800 mg är särskilt utsatta.
Nedsatt fenylalaninmetabolism
Trimetoprim, en komponent i BACTRIM, har noterats försämra fenylalaninmetabolismen, men detta har ingen betydelse för fenylketonuriska patienter med lämplig dietrestriktion.
Porfyri och hypotyreos
Liksom andra läkemedel som innehåller sulfonamider kan BACTRIM utlösa porfyrikris och hypotyreos. Undvik användning av BACTRIM hos patienter med porfyri eller sköldkörteldysfunktion.
Potentiell risk vid behandling av Pneumocystis jirovecii lunginflammation hos patienter med förvärvat immunbristsyndrom (AIDS)
AIDS-patienter kanske inte tolererar eller svarar på BACTRIM på samma sätt som icke-AIDS-patienter. Incidensen av biverkningar, särskilt hudutslag, feber, leukopeni och förhöjda aminotransferasvärden (transaminas) med BACTRIM-behandling hos AIDS-patienter som behandlas för Pneumocystis jirovecii pneumoni har rapporterats vara avsevärt ökad jämfört med incidensen som normalt är förknippad med användning av BACTRIM 800mg hos icke-aidspatienter. Om en patient utvecklar hudutslag eller tecken på en biverkning, omvärdera behandlingen med BACTRIM [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Undvik samtidig administrering av BACTRIM 80 mg och leukovorin under behandling av Pneumocystis jirovecii pneumoni [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Elektrolytavvikelser
Höga doser av trimetoprim, som används till patienter med P. jirovecii pneumoni, inducerar en progressiv men reversibel ökning av serumkaliumkoncentrationerna hos ett betydande antal patienter. Även behandling med rekommenderade doser kan orsaka hyperkalemi när trimetoprim ges till patienter med underliggande störningar av kaliummetabolismen, med njurinsufficiens eller om läkemedel som är kända för att inducera hyperkalemi ges samtidigt. Noggrann övervakning av serumkalium är berättigad hos dessa patienter.
Allvarlig och symtomatisk hyponatremi kan förekomma hos patienter som får BACTRIM 800 mg, särskilt för behandling av P. jirovecii pneumoni. Utvärdering av hyponatremi och lämplig korrigering är nödvändig hos symtomatiska patienter för att förhindra livshotande komplikationer.
Se till att du får tillräckligt med vätskeintag och urinflöde under behandlingen för att förhindra kristalluri. Patienter som är "långsamma acetylatorer" kan vara mer benägna att få idiosynkratiska reaktioner på sulfonamider.
Övervakning av laboratorietester
Fullständiga blodvärden ska göras ofta hos patienter som får BACTRIM. Avbryt BACTRIM 800 mg om en signifikant minskning av antalet bildade blodelement noteras. Utför urinanalyser med noggrann mikroskopisk undersökning och njurfunktionstester under behandlingen, särskilt för patienter med nedsatt njurfunktion.
Utveckling av läkemedelsresistenta bakterier
Att förskriva BACTRIM i frånvaro av en bevisad eller starkt misstänkt bakterieinfektion eller en profylaktisk indikation är osannolikt att ge patienten nytta och ökar risken för utveckling av läkemedelsresistenta bakterier.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Carcinogenes
Sulfametoxazol var inte cancerframkallande när det bedömdes i en 26-veckors studie av tumörframkallande mus (Tg-rasH2) vid doser upp till 400 mg/kg/dag sulfametoxazol; motsvarande 2 gånger den humana systemiska exponeringen (vid en daglig dos på 800 mg sulfametoxazol två gånger dagligen (två gånger om dagen).
Mutagenes
In vitro omvänd mutation bakteriella tester enligt standardprotokollet har inte utförts med sulfametoxazol och trimetoprim i kombination. Ett in vitro kromosomavvikelsetest i humana lymfocyter med sulfametoxazol/trimetoprim var negativt. I in vitro- och in vivo-tester på djurarter skadade inte sulfametoxazol/trimetoprim kromosomerna. In vivo mikronukleusanalyser var positiva efter oral administrering av sulfametoxazol/trimetoprim. Observationer av leukocyter erhållna från patienter behandlade med sulfametoxazol och trimetoprim visade inga kromosomavvikelser.
Enbart sulfametoxazol var positivt i en bakteriell analys av omvänd mutation in vitro och i mikrokärnanalyser in vitro med odlade humana lymfocyter.
Trimetoprim enbart var negativt i in vitro omvänd mutationsbakterieanalys och i in vitro kromosomavvikelseanalyser med kinesisk hamster ovarie- eller lungceller med eller utan S9-aktivering. In vitro analyser av Comet, mikronukleus och kromosomskador med odlade humana lymfocyter var trimetoprim positivt. Hos möss efter oral administrering av trimetoprim registrerades ingen DNA-skada i Comet-analyser av lever, njure, lunga, mjälte eller benmärg.
Nedsättning av fertilitet
Inga negativa effekter på fertilitet eller allmän fortplantningsförmåga observerades hos råttor som fick orala doser så höga som 350 mg/kg/dag sulfametoxazol plus 70 mg/kg/dag trimetoprim, doser ungefär två gånger den rekommenderade dagliga dosen för människor på basis av kroppsyta. .
Användning i specifika populationer
Graviditet
Risksammanfattning
BACTRIM kan orsaka fosterskador om det ges till en gravid kvinna. Vissa epidemiologiska studier tyder på att exponering för BACTRIM 400 mg under graviditet kan vara associerad med en ökad risk för medfödda missbildningar, särskilt neuralrörsdefekter, kardiovaskulära avvikelser, urinvägsdefekter, munspalt och klumpfot (se Mänskliga data ).
En av 3 råttstudier visade gomspalt vid doser som var ungefär 5 gånger den rekommenderade humandosen på basis av kroppsyta; de andra 2 studierna visade inte teratogenicitet vid liknande doser. Studier på dräktiga kaniner visade ökad fosterförlust vid cirka 6 gånger den mänskliga dosen på basis av kroppsytan (se Djurdata ).
Den uppskattade bakgrundsrisken för stora fosterskador och missfall för den indikerade populationen är okänd. I den allmänna befolkningen i USA är den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall i kliniskt erkända graviditeter 2 % till 4 % respektive 15 % till 20 %. Informera gravida kvinnor om den potentiella skadan av BACTRIM 400 mg på fostret (se Kliniska överväganden ).
Kliniska överväganden
Sjukdomsrelaterad risk för mödrar och/eller embryon/foster
Urinvägsinfektion under graviditet är associerad med negativa perinatala utfall såsom för tidig födsel, låg födelsevikt och havandeskapsförgiftning och ökad dödlighet hos den gravida kvinnan. P. jirovecii lunginflammation under graviditet är associerad med för tidig födsel och ökad sjuklighet och dödlighet för den gravida kvinnan. BACTRIM ska endast användas under graviditet om den potentiella nyttan överväger den potentiella risken för fostret.
Data
Mänskliga data
Även om det inte finns några stora, prospektiva, välkontrollerade studier på gravida kvinnor och deras spädbarn, tyder vissa retrospektiva epidemiologiska studier på ett samband mellan första trimesterns exponering för BACTRIM 80 mg med en ökad risk för medfödda missbildningar, särskilt neuralrörsdefekter, kardiovaskulära avvikelser, urinvägar. luftvägsdefekter, munspalt och klubbfot. Dessa studier var dock begränsade av det lilla antalet exponerade fall och avsaknaden av justering för flera statistiska jämförelser och konfounders. Dessa studier begränsas ytterligare av återkallande, urval och informationsfördomar, och av begränsad generaliserbarhet av deras resultat. Slutligen varierade resultatmåtten mellan studierna, vilket begränsade jämförelser mellan studier. Alternativt har andra epidemiologiska studier inte upptäckt statistiskt signifikanta samband mellan BACTRIM 160 mg exponering och specifika missbildningar. Brumfitt och Pursell10 rapporterade i en retrospektiv studie resultatet av 186 graviditeter under vilka modern fick antingen placebo eller oral trimetoprim och sulfametoxazol. Incidensen av medfödda avvikelser var 4,5 % (3 av 66) hos dem som fick placebo och 3,3 % (4 av 120) hos dem som fick trimetoprim och sulfametoxazol. Det fanns inga avvikelser hos de 10 barn vars mödrar fick läkemedlet under den första trimestern. I en separat undersökning fann Brumfitt och Pursell inte heller några medfödda avvikelser hos 35 barn vars mödrar hade fått oral trimetoprim och sulfametoxazol vid tidpunkten för befruktningen eller kort därefter.
Djurdata
Hos råttor gav orala doser av antingen 533 mg/kg sulfametoxazol eller 200 mg/kg trimetoprim teratologiska effekter som främst manifesterades som gomspalt. Dessa doser är cirka 5 och 6 gånger den rekommenderade totala dagliga dosen för människor på basis av kroppsyta. I två studier på råttor observerades ingen teratologi när 512 mg/kg sulfametoxazol användes i kombination med 128 mg/kg trimetoprim. I vissa kaninstudier var en total ökning av fosterförlust (döda och resorberade begrepp) associerad med doser av trimetoprim 6 gånger den humana terapeutiska dosen baserat på kroppsyta.
Laktation
Risksammanfattning
Nivåerna av BACTRIM i bröstmjölk är cirka 2 till 5 % av den rekommenderade dagliga dosen för pediatriska patienter över två månaders ålder. Det finns ingen information om effekten av BACTRIM på det ammade barnet eller effekten på mjölkproduktionen. På grund av den potentiella risken för bilirubinförskjutning och kernicterus hos det ammade barnet [se KONTRAINDIKATIONER ], råder kvinnor att undvika amning under behandling med BACTRIM.
Pediatrisk användning
BACTRIM är kontraindicerat till pediatriska patienter yngre än två månader på grund av den potentiella risken för bilirubinförskjutning och kernicterus [se KONTRAINDIKATIONER ].
Allvarliga biverkningar inklusive dödliga reaktioner och "gasping-syndromet" inträffade hos prematura nyfödda och spädbarn med låg födelsevikt på den neonatala intensivvårdsavdelningen som fick bensylalkohol som konserveringsmedel i infusionslösningar. I dessa fall gav bensylalkoholdoser på 99 till 234 mg/kg/dag höga nivåer av bensylalkohol och dess metaboliter i blodet och urinen (nivåerna av bensylalkohol i blodet var 0,61 till 1,378 mmol/L). Ytterligare biverkningar inkluderade gradvis neurologisk försämring, kramper, intrakraniell blödning, hematologiska abnormiteter, hudnedbrytning, lever- och njursvikt, hypotoni, bradykardi och kardiovaskulär kollaps. För tidigt födda spädbarn med låg födelsevikt kan vara mer benägna att utveckla dessa reaktioner eftersom de kan ha mindre förmåga att metabolisera bensylalkohol.
När du förskriver BACTRIM 800 mg till pediatriska patienter, beakta den kombinerade dagliga metaboliska belastningen av bensylalkohol från alla källor inklusive BACTRIM (BACTRIM 160 mg innehåller 10 mg bensylalkohol per ml) och andra läkemedel som innehåller bensylalkohol. Den minsta mängd bensylalkohol vid vilken allvarliga biverkningar kan uppstå är inte känd [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Geriatrisk användning
Kliniska studier av BACTRIM inkluderade inte tillräckligt många försökspersoner i åldern 65 år och äldre för att avgöra om de svarar annorlunda än yngre försökspersoner.
Det kan finnas en ökad risk för allvarliga biverkningar hos äldre patienter, särskilt när det finns komplicerade tillstånd, t.ex. nedsatt njur- och/eller leverfunktion, eller samtidig användning av andra läkemedel. Allvarliga hudreaktioner, generaliserad benmärgsdämpning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , NEGATIVA REAKTIONER ], en specifik minskning av blodplättar (med eller utan purpura) och hyperkalemi är de vanligast rapporterade allvarliga biverkningarna hos äldre patienter.
Hos dem som samtidigt får vissa diuretika, främst tiazider, har en ökad incidens av trombocytopeni med purpura rapporterats. Ökade digoxinnivåer i blodet kan förekomma vid samtidig behandling med BACTRIM 80 mg, särskilt hos äldre patienter. Digoxinnivåer i serum bör övervakas [se LÄKEMEDELSINTERAKTIONER ].
Hematologiska förändringar som tyder på folsyrabrist kan förekomma hos äldre patienter. Dessa effekter är reversibla med folinsyraterapi. Lämpliga dosjusteringar bör göras för patienter med nedsatt njurfunktion och användningstiden bör vara så kort som möjligt för att minimera riskerna för oönskade reaktioner [se DOSERING OCH ADMINISTRERING ].
Trimetoprimkomponenten i BACTRIM kan orsaka hyperkalemi när den ges till patienter med underliggande störningar av kaliummetabolismen, med njurinsufficiens eller när den ges samtidigt med läkemedel som är kända för att inducera hyperkalemi, såsom angiotensinkonverterande enzymhämmare. Noggrann övervakning av serumkalium är berättigad hos dessa patienter. Att avbryta behandlingen med BACTRIM 160 mg rekommenderas för att sänka serumnivåerna av kalium.
Farmakokinetiska parametrar för sulfametoxazol var likartade för geriatriska och yngre vuxna. Den genomsnittliga maximala serumkoncentrationen av trimetoprim var högre och genomsnittlig renal clearance av trimetoprim var lägre hos geriatriska försökspersoner jämfört med yngre försökspersoner [se KLINISK FARMAKOLOGI ].
REFERENSER
4. Safrin S, Lee BL, Sande MA. Tillägg av folinsyra med trimetoprim-sulfametoxazol för Pneumocystis carinii pneumoni hos AIDS-patienter är associerat med en ökad risk för terapeutiskt misslyckande och död. J Infect Dis. okt 1994;170(4):912-7.
10. Brumfitt W, Pursell R. Trimetoprim/Sulfamethoxazole in the Treatment of Bacteriuria in Women. J Infect Dis. Nov 1973;128 (Suppl): S657-S663.
ÖVERDOS
Akut
Eftersom det inte har funnits någon omfattande erfarenhet hos människor av engångsdoser av BACTRIM 160 mg över 25 ml (400 mg trimetoprim och 2000 mg sulfametoxazol), är den maximala tolererade dosen hos människor okänd.
Tecken och symtom på överdosering som rapporterats med sulfonamider inkluderar anorexi, kolik, illamående, kräkningar, yrsel, huvudvärk, dåsighet och medvetslöshet. Pyrexi, hematuri och kristalluri kan noteras. Bloddyskrasier och gulsot är potentiella sena manifestationer av överdosering.
Tecken på akut överdosering med trimetoprim inkluderar illamående, kräkningar, yrsel, huvudvärk, mental depression, förvirring och benmärgsdepression.
Allmänna behandlingsprinciper inkluderar administrering av intravenösa vätskor om urinproduktionen är låg och njurfunktionen är normal. Försurning av urinen ökar renal eliminering av trimetoprim. Patienten bör övervakas med blodvärden och lämplig blodkemi, inklusive elektrolyter. Om en betydande bloddyskrasi eller gulsot inträffar, bör specifik behandling sättas in för dessa komplikationer. Peritonealdialys är inte effektivt och hemodialys är endast måttligt effektiv för att eliminera trimetoprim och sulfametoxazol.
Kronisk
Användning av BACTRIM 800 mg i höga doser och/eller under längre tidsperioder kan orsaka benmärgsdepression, manifesterad som trombocytopeni, leukopeni och/eller megaloblastisk anemi. Om tecken på benmärgsdepression uppstår, ska patienten ges leukovorin 5 till 15 mg dagligen tills normal hematopoiesis är återställd.
KONTRAINDIKATIONER
BACTRIM är kontraindicerat i följande:
- Känd överkänslighet mot trimetoprim eller sulfonamider [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Historik med läkemedelsinducerad immuntrombocytopeni med användning av trimetoprim och/eller sulfonamider [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Patienter med dokumenterad megaloblastisk anemi på grund av folatbrist [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Pediatriska patienter yngre än två månader [se Användning i specifika populationer ]
- Markerad leverskada [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Allvarlig njurinsufficiens när njurfunktionsstatus inte kan övervakas [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Samtidig administrering med dofetilid2,3 [se LÄKEMEDELSINTERAKTIONER ]
REFERENSER
2. Al-Khatib SM, LaPointe N, Kramer JM, Califf RM. Vad läkare bör veta om QT-intervallet. JAMA. 2003;289(16):2120-2127.
3. Boyer EW, Stork C, Wang RY. Översyn: Dofetilids farmakologi och toxikologi. Int J Med Toxicol. 2001;4(2):16.
KLINISK FARMAKOLOGI
Handlingsmekanism
BACTRIM är ett antimikrobiellt läkemedel [se Mikrobiologi ].
Farmakokinetik
Efter en 1-timmes intravenös infusion av en engångsdos på 160 mg trimetoprim och 800 mg sulfametoxazol till 11 patienter vars vikt varierade från 105 lbs till 165 lbs (medelvärde 143 lbs), var de högsta plasmakoncentrationerna av trimetoprim och sulfametoprim ± sulfametox4 ± 03.34azol. μg/mL respektive 46,3 ± 2,7 μg/mL. Efter upprepad intravenös administrering av samma dos med 8 timmars intervall var medelplasmakoncentrationerna precis före och omedelbart efter varje infusion vid steady state 5,6 ± 0,6 μg/ml och 8,8 ± 0,9 μg/ml för trimetoprim och 70,6 ± 7,3 μg /ml och 105,6 ± 10,9 μg/mL för sulfametoxazol. Den genomsnittliga halveringstiden i plasma var 11,3 ± 0,7 timmar för trimetoprim och 12,8 ± 1,8 timmar för sulfametoxazol. Alla dessa 11 patienter hade normal njurfunktion och deras ålder varierade från 17 till 78 år (median, 60 år).11
Farmakokinetiska studier på barn och vuxna tyder på en åldersberoende halveringstid för trimetoprim, som anges i tabell 5.12
Patienter med gravt nedsatt njurfunktion uppvisar en ökning av halveringstiderna för båda komponenterna, vilket kräver justering av dosregim [se DOSERING OCH ADMINISTRERING ].
Distribution
Både trimetoprim och sulfametoxazol finns i blodet som obundna, proteinbundna och metaboliserade former; sulfametoxazol existerar också som den konjugerade formen.
Cirka 44 % av trimetoprim och 70 % av sulfametoxazol är bundna till plasmaproteiner. Närvaron av 10 mg procent sulfametoxazol i plasma minskar proteinbindningen av trimetoprim i en obetydlig grad; trimetoprim påverkar inte proteinbindningen av sulfametoxazol.
Både trimetoprim och sulfametoxazol distribueras till sputum och vaginalvätska; trimetoprim distribueras också till bronkial sekret, och båda passerar placentabarriären och utsöndras i bröstmjölk.
Eliminering
Ämnesomsättning
Sulfametoxazol metaboliseras hos människor till minst 5 metaboliter: N4-acetyl-, N4-hydroxi-, 5metylhydroxi-, N4-acetyl-5-metylhydroxisulfametoxazolmetaboliter och ett N-glukuronidkonjugat. Bildningen av N4-hydroximetabolit medieras via CYP2C9.
Trimetoprim metaboliseras in vitro till 11 olika metaboliter, varav fem är glutationaddukter och sex är oxidativa metaboliter, inklusive huvudmetaboliterna 1- och 3-oxider och 3- och 4-hydroxiderivaten.
De fria formerna av trimetoprim och sulfametoxazol anses vara de terapeutiskt aktiva formerna. In vitro-studier tyder på att trimetoprim är ett substrat för P-glykoprotein, OCT1 och OCT2, och att sulfametoxazol inte är ett substrat för P-glykoprotein.
Exkretion
Utsöndring av trimetoprim och sulfametoxazol sker främst genom njurarna genom både glomerulär filtration och tubulär sekretion. Urinkoncentrationerna av både trimetoprim och sulfametoxazol är betydligt högre än koncentrationerna i blodet. Procentandelen av dosen som utsöndras i urinen under en 12-timmarsperiod efter intravenös administrering av den första dosen på 240 mg trimetoprim och 1200 mg sulfametoxazol dag 1 varierade från 17 % till 42,4 % som fri trimetoprim; 7 % till 12,7 % som fri sulfametoxazol; och 36,7 % till 56 % totalt (fritt plus den N4-acetylerade metaboliten) sulfametoxazol. När de administreras tillsammans som BACTRIM 400 mg påverkar varken trimetoprim eller sulfametoxazol utsöndringsmönstret i urinen hos den andra.
Specifika populationer
Geriatriska patienter
Farmakokinetiken för sulfametoxazol 800 mg och trimetoprim 160 mg studerades hos sex geriatriska försökspersoner (medelålder: 78,6 år) och sex unga friska försökspersoner (medelålder: 29,3 år) med en icke-amerikanskt godkänd formulering. Farmakokinetiska värden för sulfametoxazol hos geriatriska försökspersoner liknade de som observerades hos unga vuxna försökspersoner. Det genomsnittliga renala clearance av trimetoprim var signifikant lägre hos geriatriska försökspersoner jämfört med unga vuxna försökspersoner (19 mL/h/kg mot 55 mL/h/kg). Efter normalisering efter kroppsvikt var det skenbara totala kroppsclearancen av trimetoprim i genomsnitt 19 % lägre hos geriatriska försökspersoner jämfört med unga vuxna försökspersoner.
Mikrobiologi
Handlingsmekanism
Sulfametoxazol hämmar bakteriesyntesen av dihydrofolsyra genom att konkurrera med para-aminobensoesyra (PABA). Trimetoprim blockerar produktionen av tetrahydrofolsyra från dihydrofolsyra genom att binda till och reversibelt hämma det nödvändiga enzymet dihydrofolatreduktas. Således blockerar sulfametoxazol och trimetoprim två på varandra följande steg i biosyntesen av nukleinsyror och proteiner som är väsentliga för många bakterier.
Motstånd
In vitro-studier har visat att bakteriell resistens utvecklas långsammare med både sulfametoxazol och trimetoprim i kombination än med antingen sulfametoxazol eller trimetoprim enbart.
Antimikrobiell aktivitet
BACTRIM har visat sig vara aktivt mot de flesta isolat av följande mikroorganismer, både in vitro och vid kliniska infektioner [se INDIKATIONER OCH ANVÄNDNING ].
Aeroba gramnegativa bakterier
Escherichia coliKlebsiella-arterEnterobacter-arterMorganella morganiiProteus mirabilisProteus vulgarisShigella flexneriShigella sonnei
Andra mikroorganismer
Pneumocystis jirovecii
Följande in vitro-data finns tillgängliga, men deras kliniska betydelse är okänd. Minst 90 procent av följande bakterier uppvisar en in vitro minsta hämmande koncentration (MIC) mindre än eller lika med den mottagliga brytpunkten för BACTRIM 160 mg mot isolat av liknande släkte eller organismgrupp. Effekten av BACTRIM 400 mg vid behandling av kliniska infektioner orsakade av dessa bakterier har dock inte fastställts i adekvata och välkontrollerade kliniska prövningar.
Aeroba grampositiva bakterier
Streptococcus pneumoniae
Aeroba gramnegativa bakterier
Haemophilus influenzae
Känslighetstestning
För specifik information om tolkningskriterier för känslighetstest och tillhörande testmetoder och kvalitetskontrollstandarder erkända av FDA för detta läkemedel, se https://www.fda.gov/STIC.
REFERENSER
11. Grose WE, Bodey GP, Loo TL. Klinisk farmakologi av intravenöst administrerat trimetoprim-sulfametoxazol. Antimikrobiska medel Kemother. Mar 1979;15:447-451.
12. Siber GR, Gorham C, Durbin W, Lesko L, Levin MJ. Farmakologi av intravenös trimetoprim-sulfametoxazol hos barn och vuxna. Aktuell kemoterapi och infektionssjukdomar. American Society for Microbiology, Washington, DC 1980; Vol. 1, sid. 691-692.
PATIENTINFORMATION
Embryo fostertoxicitet
Informera kvinnliga patienter med reproduktionspotential att BACTRIM kan orsaka fosterskador och att informera sin vårdgivare om en känd eller misstänkt graviditet [se Användning i specifika populationer ].
Laktation
Rekommendera ammande kvinnor att undvika amning under behandling med BACTRIM.
Antibakteriell resistens
Informera patienter om att antibakteriella läkemedel inklusive BACTRIM endast ska användas för att behandla bakterieinfektioner. Det behandlar inte virusinfektioner (t.ex. förkylning).
Instruera patienterna att upprätthålla ett adekvat vätskeintag för att förhindra kristalluri och stenbildning.
Diarre
Informera patienter om att diarré är ett vanligt problem som orsakas av antibiotika som vanligtvis upphör när antibiotikan avbryts. Ibland kan patienter efter påbörjad behandling med antibiotika utveckla vattnig och blodig avföring (med eller utan magkramper och feber) även så sent som två eller fler månader efter att ha tagit den sista dosen av antibiotikan. Om detta inträffar ska patienter kontakta sin läkare så snart som möjligt.
