Zocor 5mg, 10mg, 20mg, 40mg Simvastatin Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Zocor och hur används det?
Zocor (simvastatin) är ett receptbelagt läkemedel som används för att sänka nivåerna av "dåligt" kolesterol (lågdensitetslipoprotein eller LDL) och för att öka nivåerna av "bra" kolesterol (högdensitetslipoprotein eller HDL) och för att sänka triglycerin samt för att minska risken för stroke och hjärtinfarkt. Zocor kan användas ensamt eller tillsammans med andra läkemedel.
Zocor tillhör en klass av läkemedel som kallas lipidsänkande medel, statiner, HMG-CoA-reduktashämmare.
Det är inte känt om Zocor är säkert och effektivt för barn yngre än 10 år.
Vilka är möjliga biverkningar av Zocor?
Zocor 20mg kan orsaka allvarliga biverkningar inklusive:
- aptitlöshet,
- magsmärtor i övre högra sidan,
- trötthet,
- klåda,
- mörk urin,
- lerfärgad pall, och
- gulfärgning av huden eller ögonen
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Zocor inkluderar:
- huvudvärk,
- illamående,
- magont,
- förstoppning och
- förkylningssymtom (täppt näsa, nysningar eller ont i halsen)
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Zocor. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
ZOCOR (simvastatin) är ett lipidsänkande medel som är syntetiskt härlett från en fermenteringsprodukt av Aspergillus terreus. Efter oralt intag hydrolyseras simvastatin, som är en inaktiv lakton, till motsvarande β-hydroxisyraform. Detta är en hämmare av 3-hydroxi-3-metylglutaryl-koenzym A (HMG-CoA) reduktas. Detta enzym katalyserar omvandlingen av HMG-CoA till mevalonat, vilket är ett tidigt och hastighetsbegränsande steg i biosyntesen av kolesterol.
Simvastatin är butansyra, 2,2-dimetyl-,1,2,3,7,8,8a-hexahydro-3,7-dimetyl-8-[2-(tetrahydro-4hydroxi-6-oxo-2H-pyran- 2-yl)-etyl]-l-naftalenylester, [lS-[la,3a,7p,8p(2S*,4S*),-8aP]]. Den empiriska formeln för simvastatin är C25H38O5 och dess molekylvikt är 418,57. Dess strukturformel är:
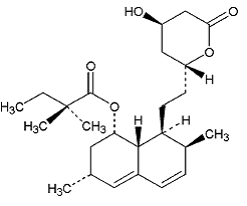
Simvastatin är ett vitt till benvitt, icke-hygroskopiskt, kristallint pulver som är praktiskt taget olösligt i vatten och fritt lösligt i kloroform, metanol och etanol.
Tabletter ZOCOR för oral administrering innehåller antingen 5 mg, 10 mg, 20 mg, 40 mg eller 80 mg simvastatin och följande inaktiva ingredienser: askorbinsyra, citronsyra, hydroxipropylcellulosa, hypromellos, järnoxider, laktos, magnesiumstearat, mikrokristallin cellulosa stärkelse, talk och titandioxid. Butylerad hydroxyanisol tillsätts som konserveringsmedel.
INDIKATIONER
Terapi med lipidförändrande medel bör endast vara en komponent i multipel riskfaktorintervention hos individer med signifikant ökad risk för aterosklerotisk kärlsjukdom på grund av hyperkolesterolemi. Läkemedelsbehandling är indicerat som ett komplement till kosten när svaret på en diet begränsad i mättat fett och kolesterol och andra icke-farmakologiska åtgärder enbart har varit otillräckligt. Hos patienter med kranskärlssjukdom (CHD) eller med hög risk för CHD, kan ZOCOR® startas samtidigt med diet.
Minskad risk för CHD-dödlighet och kardiovaskulära händelser
Hos patienter med hög risk för kranskärlshändelser på grund av befintlig kranskärlssjukdom, diabetes, perifer kärlsjukdom, stroke eller annan cerebrovaskulär sjukdom i anamnesen, är ZOCOR 5mg indicerat för att:
- Minska risken för total dödlighet genom att minska dödsfall i CHD.
- Minska risken för icke-dödlig hjärtinfarkt och stroke.
- Minska behovet av koronära och icke-koronära revaskulariseringsprocedurer.
Hyperlipidemi
ZOCOR indikeras till:
- Minska förhöjt totalkolesterol (total-C), lågdensitetslipoproteinkolesterol (LDL-C), apolipoprotein B (Apo B) och triglycerider (TG), och för att öka högdensitetslipoproteinkolesterol (HDL-C) hos patienter med primär hyperlipidemi (Fredrickson typ IIa, heterozygot familjär och icke-familiell) eller blandad dyslipidemi (Fredrickson typ IIb).
- Minska förhöjd TG hos patienter med hypertriglyceridemi (Fredrickson typ lV hyperlipidemi).
- Minska förhöjd TG och VLDL-C hos patienter med primär dysbetalipoproteinemi (Fredrickson typ III hyperlipidemi).
- Minska total-C och LDL-C hos patienter med homozygot familjär hyperkolesterolemi (HoFH) som ett komplement till andra lipidsänkande behandlingar (t.ex. LDL-aferes) eller om sådana behandlingar inte är tillgängliga.
Ungdomspatienter med heterozygot familjär hyperkolesterolemi (HeFH)
ZOCOR är indicerat som ett komplement till kosten för att minska total-C, LDL-C och Apo B-nivåer hos pojkar och flickor som är minst ett år efter menarken, 10-17 år gamla, med HeFH, om efter en adekvat prövning av dietterapi följande resultat finns:
- Det finns en positiv familjehistoria av prematur hjärt-kärlsjukdom (CVD) eller
- Två eller flera andra riskfaktorer för hjärt-kärlsjukdom finns hos den tonåriga patienten.
Det lägsta målet för behandling av barn och ungdomar är att uppnå en genomsnittlig LDL-C
Användningsbegränsningar
ZOCOR 20 mg har inte studerats vid tillstånd där den största abnormiteten är förhöjda kylomikroner (dvs hyperlipidemi Fredrickson typ I och V).
DOSERING OCH ADMINISTRERING
Rekommenderad dosering
Det vanliga doseringsintervallet är 5 till 40 mg/dag. Hos patienter med CHD eller med hög risk för CHD kan ZOCOR startas samtidigt med diet. Den rekommenderade vanliga startdosen är 10 eller 20 mg en gång dagligen på kvällen. För patienter med hög risk för en CHD-händelse på grund av existerande CHD, diabetes, perifer kärlsjukdom, stroke eller annan cerebrovaskulär sjukdom, är den rekommenderade startdosen 40 mg/dag. Lipidbestämningar bör utföras efter 4 veckors behandling och periodiskt därefter.
Begränsad dosering för 80 mg
På grund av den ökade risken för myopati, inklusive rabdomyolys, särskilt under det första behandlingsåret, bör användningen av 80 mg dosen ZOCOR begränsas till patienter som har tagit simvastatin 80 mg kroniskt (t.ex. i 12 månader eller mer). utan bevis på muskeltoxicitet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Patienter som för närvarande tolererar ZOCOR-dosen på 80 mg och som behöver initieras med ett interagerande läkemedel som är kontraindicerat eller är associerat med ett dostak för simvastatin bör bytas till en alternativ statin med mindre potential för läkemedelsinteraktion.
På grund av den ökade risken för myopati, inklusive rabdomyolys, associerad med 80 mg dosen ZOCOR 40 mg, bör patienter som inte kan uppnå sitt LDL-C-mål med användning av 40 mg dosen ZOCOR 5 mg inte titreras till 80 mg dosen , men bör placeras på alternativa LDL-C-sänkande behandling(er) som ger större LDL-C-sänkning.
Samtidig administrering med andra droger
Patienter som tar Verapamil, Diltiazem eller Dronedaron
- Dosen av ZOCOR bör inte överstiga 10 mg/dag [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , LÄKEMEDELSINTERAKTIONER , och KLINISK FARMAKOLOGI ].
Patienter som tar Amiodaron, Amlodipin eller Ranolazin
- Dosen av ZOCOR 10 mg bör inte överstiga 20 mg/dag [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , LÄKEMEDELSINTERAKTIONER , och KLINISK FARMAKOLOGI ].
Patienter med homozygot familjär hyperkolesterolemi
Den rekommenderade dosen är 40 mg/dag på kvällen [Se DOSERING OCH ADMINISTRERING , Begränsad dosering för 80 mg ]. ZOCOR 5mg ska användas som ett komplement till andra lipidsänkande behandlingar (t.ex. LDL-aferes) hos dessa patienter eller om sådana behandlingar inte är tillgängliga.
Simvastatinexponeringen fördubblas ungefär vid samtidig användning av lomitapid; därför bör dosen av ZOCOR minskas med 50 % om lomitapid påbörjas. Doseringen av ZOCOR 5 mg bör inte överstiga 20 mg/dag (eller 40 mg/dag för patienter som tidigare har tagit ZOCOR 80 mg/dag kroniskt, t.ex. i 12 månader eller mer, utan tecken på muskeltoxicitet) medan de tar lomitapid.
Ungdomar (10-17 år) med heterozygot familjär hyperkolesterolemi
Den rekommenderade vanliga startdosen är 10 mg en gång dagligen på kvällen. Det rekommenderade doseringsintervallet är 10 till 40 mg/dag; den maximala rekommenderade dosen är 40 mg/dag. Doserna bör anpassas efter det rekommenderade målet för behandlingen [se NCEP Pediatric Panel Riktlinjer1 och Kliniska studier ]. Justeringar bör göras med intervaller på 4 veckor eller mer.
Patienter med nedsatt njurfunktion
Eftersom ZOCOR 5 mg inte utsöndras signifikant genom njurarna, bör dosjustering inte vara nödvändig hos patienter med lätt till måttligt nedsatt njurfunktion. Försiktighet bör dock iakttas när ZOCOR 20 mg ges till patienter med gravt nedsatt njurfunktion; sådana patienter bör startas med 5 mg/dag och övervakas noggrant [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och KLINISK FARMAKOLOGI ].
HUR LEVERERAS
Doseringsformer och styrkor
- Tabletter ZOCOR 5 mg är buffa, ovala, filmdragerade tabletter, kodade MSD 726 på ena sidan och ZOCOR 5 på den andra.
- Tabletter ZOCOR 10 mg är persika, ovala, filmdragerade tabletter, kodade MSD 735 på ena sidan och släta på den andra.
- Tabletter ZOCOR 20 mg är bruna, ovala, filmdragerade tabletter, kodade MSD 740 på ena sidan och släta på den andra.
- Tabletter ZOCOR 40 mg är tegelröda, ovala, filmdragerade tabletter, kodade MSD 749 på ena sidan och släta på den andra.
- Tabletter ZOCOR 80 mg är tegelröda, kapselformade, filmdragerade tabletter, kodade 543 på ena sidan och 80 på den andra.
Förvaring Och Hantering
nr 8146 - Tabletter ZOCOR 10 mg är persika, ovala, filmdragerade tabletter, kodade MSD 735 på ena sidan och släta på den andra. De levereras enligt följande:
NDC 0006-0735-31 användningsenhet flaskor med 30 st NDC 0006-0735-54 användningsenhet flaskor med 90 st.
nr 8147 - Tabletter ZOCOR 20 mg är bruna, ovala, filmdragerade tabletter, kodade MSD 740 på ena sidan och släta på den andra. De levereras enligt följande:
NDC 0006-0740-31 flaskor med 30 användningsenheter NDC 0006-0740-54 användningsenhet flaskor med 90 stycken.
nr 8148 - Tabletter ZOCOR 40 mg är tegelröda, ovala, filmdragerade tabletter, kodade MSD 749 på ena sidan och släta på den andra. De levereras enligt följande:
NDC 0006-0749-31 användningsenhet flaskor med 30 st NDC 0006-0749-54 användningsenhetsflaskor med 90 st.
nr 6577 - Tabletter ZOCOR 80 mg är tegelröda, kapselformade, filmdragerade tabletter, kodade 543 på ena sidan och 80 på den andra. De levereras enligt följande:
NDC 0006-0543-31 användningsenhet flaskor med 30 st NDC 0006-0543-54 flaskor med 90 användningsenheter.
Lagring
Förvaras mellan 5-30°C (41-86°F).
1National Cholesterol Education Program (NCEP): Höjdpunkter i rapporten från expertpanelen om blodkolesterolnivåer hos barn och ungdomar. Pediatrik. 89(3):495-501. 1992.
Tillverkad av: Merck Sharp & Dohme Ltd. Cramlington, Northumberland, Storbritannien NE23 3JU. Reviderad: september 2020
BIEFFEKTER
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
de kontrollerade kliniska studierna före marknadsintroduktion och deras öppna förlängningar (2 423 patienter med medianuppföljningstid på cirka 18 månader), avbröts 1,4 % av patienterna på grund av biverkningar. De vanligaste biverkningarna som ledde till att behandlingen avbröts var: gastrointestinala störningar (0,5 %), myalgi (0,1 %) och artralgi (0,1 %). De vanligaste rapporterade biverkningarna (incidens ≥5 %) i simvastatinkontrollerade kliniska prövningar var: övre luftvägsinfektioner (9,0 %), huvudvärk (7,4 %), buksmärtor (7,3 %), förstoppning (6,6 %) och illamående (5,4 %). %).
Skandinavisk Simvastatin Survival Study
I 4S som involverade 4 444 (åldersintervall 35-71 år, 19 % kvinnor, 100 % kaukasier) behandlade med 20-40 mg/dag ZOCOR (n=2 221) eller placebo (n=2 223) under en median av 5,4 år, negativt Reaktioner som rapporterats hos ≥2 % av patienterna och i en frekvens som är högre än placebo visas i Tabell 2.
Hjärtskyddsstudie
Heart Protection Study (HPS), som involverade 20 536 patienter (åldersintervall 40-80 år, 25 % kvinnor, 97 % kaukasier, 3 % andra raser) behandlade med ZOCOR 40 mg/dag (n=10 269) eller placebo (n= 10 267) under ett medeltal på 5 år, registrerades endast allvarliga biverkningar och utsättningar på grund av eventuella biverkningar. Antalet utsättningar på grund av biverkningar var 4,8 % hos patienter som behandlades med ZOCOR 10 mg jämfört med 5,1 % hos patienter som behandlades med placebo. Incidensen av myopati/rabdomyolys var
Andra kliniska studier
en klinisk prövning där 12 064 patienter med hjärtinfarkt i anamnesen behandlades med ZOCOR (medeluppföljning 6,7 år), förekomsten av myopati (definierad som oförklarad muskelsvaghet eller smärta med ett serumkreatinkinas [CK] >10 gånger övre normalgräns [ULN]) hos patienter på 80 mg/dag var cirka 0,9 % jämfört med 0,02 % för patienter på 20 mg/dag. Incidensen av rabdomyolys (definierad som myopati med CK >40 gånger ULN) hos patienter på 80 mg/dag var cirka 0,4 % jämfört med 0 % för patienter på 20 mg/dag. Incidensen av myopati, inklusive rabdomyolys, var högst under det första året och minskade sedan märkbart under de efterföljande behandlingsåren. I denna studie övervakades patienterna noggrant och vissa interagerande läkemedel exkluderades.
Andra biverkningar som rapporterats i kliniska prövningar var: diarré, hudutslag, dyspepsi, flatulens och asteni.
Laboratorietester
Markerade ihållande ökningar av levertransaminaser har noterats [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Förhöjt alkaliskt fosfatas och y-glutamyltranspeptidas har också rapporterats. Cirka 5 % av patienterna hade förhöjda CK-nivåer på 3 eller fler gånger normalvärdet vid ett eller flera tillfällen. Detta var hänförligt till den icke-hjärtade fraktionen av CK. [ser VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Ungdomspatienter (åldrar 10-17 år)
I en 48-veckors kontrollerad studie på unga pojkar och flickor som var minst 1 år efter menarken, 10-17 år (43,4 % kvinnor, 97,7 % kaukasier, 1,7 % latinamerikaner, 0,6 % multiracial) med heterozygot familjär hyperkolesterolemi (n=175), behandlad med placebo eller ZOCOR (10-40 mg dagligen), de vanligaste biverkningarna som observerades i båda grupperna var övre luftvägsinfektion, huvudvärk, buksmärtor och illamående [se Användning i specifika populationer och Kliniska studier ].
Erfarenhet efter marknadsföring
Eftersom nedanstående reaktioner rapporteras frivilligt från en population av osäker storlek är det i allmänhet inte möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering. Följande ytterligare biverkningar har identifierats under användning av simvastatin efter godkännande: klåda, alopeci, en mängd olika hudförändringar (t.ex. knölar, missfärgning, torr hud/slemhinnor, förändringar i hår/naglar), yrsel, muskelkramper, myalgi , pankreatit, parestesi, perifer neuropati, kräkningar, anemi, erektil dysfunktion, interstitiell lungsjukdom, rabdomyolys, hepatit/gulsot, dödlig och icke-fatal leversvikt och depression.
Det har förekommit sällsynta rapporter om immunmedierad nekrotiserande myopati i samband med statinanvändning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Ett uppenbart överkänslighetssyndrom har rapporterats i sällsynta fall som har inkluderat några av följande kännetecken: anafylaxi, angioödem, lupus erythematous-liknande syndrom, polymyalgia rheumatica, dermatomyosit, vaskulit, purpura, trombocytopeni, leukopeni, hemolytisk anemi, ESR-positiv, ANA-positiv anemi. , artrit, artralgi, urtikaria, asteni, ljuskänslighet, feber, frossa, rodnad, sjukdomskänsla, dyspné, toxisk epidermal nekrolys, erythema multiforme, inklusive Stevens-Johnsons syndrom.
Det har förekommit sällsynta rapporter om kognitiv funktionsnedsättning (t.ex. minnesförlust, glömska, minnesförlust, minnesförsämring, förvirring) i samband med användning av statiner efter marknadsföring. Dessa kognitiva problem har rapporterats för alla statiner. Rapporterna är i allmänhet oseriösa och reversibla vid utsättning av statin, med varierande tider till symtomdebut (1 dag till år) och symtomupplösning (median 3 veckor).
LÄKEMEDELSINTERAKTIONER
Starka CYP3A4-hämmare, cyklosporin eller danazol
Starka CYP3A4-hämmare: Simvastatin är, liksom flera andra hämmare av HMG-CoA-reduktas, ett substrat för CYP3A4. Simvastatin metaboliseras av CYP3A4 men har ingen CYP3A4-hämmande aktivitet; därför förväntas det inte påverka plasmakoncentrationerna av andra läkemedel som metaboliseras av CYP3A4.
Förhöjda plasmanivåer av HMG-CoA-reduktashämmande aktivitet ökar risken för myopati och rabdomyolys, särskilt med högre doser av simvastatin. [ser VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och KLINISK FARMAKOLOGI ] Samtidig användning av läkemedel märkta med en stark hämmande effekt på CYP3A4 är kontraindicerat [se KONTRAINDIKATIONER ]. Om behandling med itrakonazol, ketokonazol, posakonazol, vorikonazol, erytromycin, klaritromycin eller telitromycin är oundviklig, måste behandlingen med simvastatin avbrytas under behandlingens gång.
Cyklosporin eller Danazol: Risken för myopati, inklusive rabdomyolys, ökar vid samtidig administrering av ciklosporin eller danazol. Därför är samtidig användning av dessa läkemedel kontraindicerat [se KONTRAINDIKATIONER , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och KLINISK FARMAKOLOGI ].
Lipidsänkande läkemedel som kan orsaka myopati när de ges ensamma
Gemfibrozil
Kontraindicerat med simvastatin [se KONTRAINDIKATIONER och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Andra fibrater
Försiktighet bör iakttas vid förskrivning med simvastatin [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Amiodaron, dronedaron, ranolazin eller kalciumkanalblockerare
Risken för myopati, inklusive rabdomyolys, ökar vid samtidig administrering av amiodaron, dronedaron, ranolazin eller kalciumkanalblockerare som verapamil, diltiazem eller amlodipin [se DOSERING OCH ADMINISTRERING och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , och tabell 3 in KLINISK FARMAKOLOGI ].
Niacin
Fall av myopati/rabdomyolys har observerats med simvastatin tillsammans med lipidmodifierande doser (≥1 g/dag niacin) av niacininnehållande produkter. Risken för myopati är större hos kinesiska patienter. I en klinisk prövning (medianuppföljning 3,9 år) som involverade patienter med hög risk för kardiovaskulär sjukdom och med välkontrollerade LDL-C-nivåer på simvastatin 40 mg/dag med eller utan ezetimib 10 mg/dag, fanns det ingen ökad fördel på kardiovaskulära utfall med tillägg av lipidmodifierande doser (≥1 g/dag) av niacin. Samtidig administrering av ZOCOR med lipidmodifierande doser (≥1 g/dag) av niacin rekommenderas inte till kinesiska patienter. Det är okänt om denna risk gäller andra asiatiska patienter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Användning i specifika populationer ].
Digoxin
I en studie resulterade samtidig administrering av digoxin och simvastatin i en lätt ökning av digoxinkoncentrationen i plasma. Patienter som tar digoxin bör övervakas på lämpligt sätt när simvastatin initieras [se KLINISK FARMAKOLOGI ].
Kumarin antikoagulantia
två kliniska studier, en på normala frivilliga och den andra på hyperkolesterolemiska patienter, förstärkte simvastatin 20-40 mg/dag måttligt effekten av kumarinantikoagulantia: protrombintiden, rapporterad som International Normalized Ratio (INR), ökade från en baslinje på 1,7 till 1,8 och från 2,6 till 3,4 i frivillig- respektive patientstudierna. Med andra statiner har kliniskt tydliga blödningar och/eller ökad protrombintid rapporterats hos ett fåtal patienter som samtidigt tar kumarinantikoagulantia. Hos sådana patienter bör protrombintiden bestämmas innan simvastatin påbörjas och tillräckligt ofta under tidig behandling för att säkerställa att ingen signifikant förändring av protrombintiden inträffar. När en stabil protrombintid väl har dokumenterats kan protrombintider övervakas med de intervaller som vanligtvis rekommenderas för patienter på kumarinantikoagulantia. Om dosen av simvastatin ändras eller avbryts ska samma procedur upprepas. Simvastatinbehandling har inte associerats med blödning eller med förändringar i protrombintid hos patienter som inte tar antikoagulantia.
Kolchicin
Fall av myopati, inklusive rabdomyolys, har rapporterats med simvastatin tillsammans med kolchicin, och försiktighet bör iakttas vid förskrivning av simvastatin med kolchicin.
Daptomycin
Fall av rabdomyolys har rapporterats med simvastatin administrerat med daptomycin. Både simvastatin och daptomycin kan orsaka myopati och rabdomyolys när de ges ensamma och risken för myopati och rabdomyolys kan öka vid samtidig administrering. Stoppa ZOCOR tillfälligt hos patienter som tar daptomycin [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
VARNINGAR
Ingår som en del av "FÖRSIKTIGHETSÅTGÄRDER" Sektion
FÖRSIKTIGHETSÅTGÄRDER
Myopati/Rabdomyolys
Simvastatin orsakar ibland myopati som manifesteras som muskelsmärta, ömhet eller svaghet med kreatinkinas (CK) över tio gånger den övre normalgränsen (ULN). Myopati tar ibland formen av rabdomyolys med eller utan akut njursvikt sekundärt till myoglobinuri, och sällsynta dödsfall har inträffat. Risken för myopati ökar av förhöjda plasmanivåer av simvastatin och simvastatinsyra. Predisponerande faktorer för myopati inkluderar hög ålder (≥65 år), kvinnligt kön, okontrollerad hypotyreos och nedsatt njurfunktion. Kinesiska patienter kan löpa ökad risk för myopati [se Användning i specifika populationer ].
Risken för myopati, inklusive rabdomyolys, är dosrelaterad. en databas för kliniska prövningar där 41 413 patienter behandlades med ZOCOR 10 mg, av vilka 24 747 (cirka 60 %) inkluderades i studier med en medianuppföljning på minst 4 år, var incidensen av myopati cirka 0,03 % och 0,08 % vid 20 respektive 40 mg/dag. Incidensen av myopati med 80 mg (0,61 %) var oproportionerligt högre än den som observerades vid de lägre doserna. I dessa prövningar övervakades patienterna noggrant och vissa interagerande läkemedel exkluderades.
en klinisk prövning där 12 064 patienter med hjärtinfarkt i anamnesen behandlades med ZOCOR (medeluppföljning 6,7 år), förekomsten av myopati (definierad som oförklarad muskelsvaghet eller smärta med ett serumkreatinkinas [CK] >10 gånger övre normalgräns [ULN]) hos patienter på 80 mg/dag var cirka 0,9 % jämfört med 0,02 % för patienter på 20 mg/dag. Incidensen av rabdomyolys (definierad som myopati med CK >40 gånger ULN) hos patienter på 80 mg/dag var cirka 0,4 % jämfört med 0 % för patienter på 20 mg/dag. Incidensen av myopati, inklusive rabdomyolys, var högst under det första året och minskade sedan märkbart under de efterföljande behandlingsåren. I denna studie övervakades patienterna noggrant och vissa interagerande läkemedel exkluderades.
Risken för myopati, inklusive rabdomyolys, är större hos patienter på simvastatin 80 mg jämfört med andra statinbehandlingar med liknande eller större LDL-C-sänkande effekt och jämfört med lägre doser av simvastatin. Därför bör 80 mg-dosen av ZOCOR endast användas för slutenvårdspatienter som har tagit simvastatin 80 mg kroniskt (t.ex. i 12 månader eller mer) utan bevis för muskeltoxicitet [Ser DOSERING OCH ADMINISTRERING , Begränsad dosering för 80 mg ]. Om en patient som för närvarande tolererar ZOCOR-dosen på 80 mg behöver initieras med ett läkemedel som interagerar som är kontraindicerat eller som är associerat med ett dostak för simvastatin, ska denna patient bytas till en alternativ statin med mindre potential för läkemedel-läkemedelsinteraktion. Patienterna ska informeras om den ökade risken för myopati, inklusive rabdomyolys, och att omedelbart rapportera oförklarad muskelsmärta, ömhet eller svaghet. Om symtom uppstår ska behandlingen avbrytas omedelbart. [ser Immunförmedlad nekrotiserande myopati ]
Alla patienter som påbörjar behandling med ZOCOR 20 mg, eller vars dos av ZOCOR ökar, bör informeras om risken för myopati, inklusive rabdomyolys, och uppmanas att omedelbart rapportera oförklarad muskelsmärta, ömhet eller svaghet, särskilt om de åtföljs av sjukdomskänsla eller feber om muskeltecken och symtomen kvarstår efter avslutad behandling med ZOCOR. ZOCOR-behandling ska avbrytas omedelbart om myopati diagnostiseras eller misstänks. de flesta fall försvann muskelsymtom och CK-ökningar när behandlingen omedelbart avbröts. Periodiska CK-bestämningar kan övervägas hos patienter som påbörjar behandling med ZOCOR 5 mg eller vars dos ökar, men det finns ingen garanti för att sådan övervakning kommer att förhindra myopati.
Många av de patienter som har utvecklat rabdomyolys under behandling med simvastatin har haft komplicerade medicinska anamneser, inklusive njurinsufficiens, vanligtvis som en konsekvens av långvarig diabetes mellitus. Sådana patienter förtjänar närmare övervakning. Behandling med ZOCOR ska avbrytas om markant förhöjda CPK-nivåer inträffar eller om myopati diagnostiseras eller misstänks. ZOCOR-behandling bör också tillfälligt avbrytas hos alla patienter som upplever ett akut eller allvarligt tillstånd som predisponerar för utveckling av njursvikt sekundärt till rabdomyolys, t.ex. sepsis; hypotoni; Stor operation; trauma; allvarliga metaboliska, endokrina eller elektrolytrubbningar; eller okontrollerad epilepsi.
Läkemedelsinteraktioner
Risken för myopati och rabdomyolys ökar av förhöjda plasmanivåer av simvastatin och simvastatinsyra. Simvastatin metaboliseras av cytokrom P450 isoform 3A4. Vissa läkemedel som hämmar denna metaboliska väg kan höja plasmanivåerna av simvastatin och kan öka risken för myopati. Dessa inkluderar itrakonazol, ketokonazol, posakonazol, vorikonazol, makrolidantibiotika erytromycin och klaritromycin, och ketolidantibiotikan telitromycin, HIV-proteashämmare, boceprevir, telaprevir, det antidepressiva medlet nefazodon, cobicistat-innehållande juicer, KLINISK FARMAKOLOGI ]. Kombination av dessa läkemedel med simvastatin är kontraindicerat. Om korttidsbehandling med starka CYP3A4-hämmare är oundviklig måste behandlingen med simvastatin avbrytas under behandlingsförloppet [se KONTRAINDIKATIONER och LÄKEMEDELSINTERAKTIONER ].
Kombinerad användning av simvastatin med gemfibrozil, ciklosporin eller danazol är kontraindicerat [se KONTRAINDIKATIONER och LÄKEMEDELSINTERAKTIONER ].
Försiktighet bör iakttas vid förskrivning av andra fibrater med simvastatin, eftersom dessa medel kan orsaka myopati när de ges ensamma och risken ökar när de administreras samtidigt [se LÄKEMEDELSINTERAKTIONER ].
Fall av myopati, inklusive rabdomyolys, har rapporterats med simvastatin tillsammans med kolchicin, och försiktighet bör iakttas vid förskrivning av simvastatin med kolchicin [se LÄKEMEDELSINTERAKTIONER ].
Fördelarna med kombinerad användning av simvastatin med följande läkemedel bör noga vägas mot de potentiella riskerna med kombinationer: andra lipidsänkande läkemedel (fibrater eller, för patienter med HoFH, lomitapid), amiodaron, dronedaron, verapamil, diltiazem, amlodipin, eller ranolazin [Se DOSERING OCH ADMINISTRERING , LÄKEMEDELSINTERAKTIONER ].
Fall av myopati, inklusive rabdomyolys, har observerats med simvastatin tillsammans med lipidmodifierande doser (≥1 g/dag niacin) av niacininnehållande produkter [se LÄKEMEDELSINTERAKTIONER ].
Fall av rabdomyolys har rapporterats med simvastatin administrerat med daptomycin. Stoppa ZOCOR tillfälligt hos patienter som tar daptomycin [se LÄKEMEDELSINTERAKTIONER ].
Förskrivningsrekommendationer för interagerande medel sammanfattas i tabell 1 [se även DOSERING OCH ADMINISTRERING , LÄKEMEDELSINTERAKTIONER , KLINISK FARMAKOLOGI ].
Immunförmedlad nekrotiserande myopati
Det har förekommit sällsynta rapporter om immunmedierad nekrotiserande myopati (IMNM), en autoimmun myopati, associerad med statinanvändning. IMNM kännetecknas av: proximal muskelsvaghet och förhöjt serumkreatinkinas, som kvarstår trots att statinbehandlingen avbryts; positiv anti-HMG CoA-reduktas-antikropp; muskelbiopsi som visar nekrotiserande myopati; och förbättring med immunsuppressiva medel. Ytterligare neuromuskulära och serologiska tester kan vara nödvändiga. Behandling med immunsuppressiva medel kan behövas. Överväg risken för IMNM noggrant innan du påbörjar ett annat statin. Om behandlingen inleds med en annan statin, övervaka för tecken och symtom på IMNM.
Leverdysfunktion
Ihållande ökningar (till mer än 3X ULN) i serumtransaminaser har inträffat hos cirka 1 % av patienterna som fått simvastatin i kliniska studier. När läkemedelsbehandlingen avbröts eller avbröts hos dessa patienter föll transaminasnivåerna vanligtvis långsamt till nivåerna före behandlingen. Ökningen var inte associerad med gulsot eller andra kliniska tecken eller symtom. Det fanns inga tecken på överkänslighet.
I Scandinavian Simvastatin Survival Study (4S) [se Kliniska studier antalet patienter med mer än en transaminashöjning till >3X ULN, under studiens gång, skilde sig inte signifikant mellan simvastatin- och placebogrupperna (14 [0,7 %] vs. 12 [0,6 %]). Förhöjda transaminaser resulterade i att 8 patienter avbröt behandlingen i simvastatingruppen (n=2 221) och 5 i placebogruppen (n=2 223). Av de 1 986 simvastatinbehandlade patienterna i 4S med normala leverfunktionstester (LFT) vid baslinjen, utvecklade 8 (0,4 %) på varandra följande LFT-höjningar till >3X ULN och/eller avbröts på grund av transaminashöjningar under de 5,4 åren (medianuppföljning) ) av studien. Bland dessa 8 patienter utvecklade 5 initialt dessa abnormiteter under det första året. Alla patienter i denna studie fick en startdos på 20 mg simvastatin; 37 % titrerades till 40 mg.
2 kontrollerade kliniska studier på 1 105 patienter var 12-månadersincidensen av ihållande förhöjda levertransaminaser utan hänsyn till läkemedelsförhållandet 0,9 % och 2,1 % vid dosen 40 respektive 80 mg. Inga patienter utvecklade ihållande leverfunktionsavvikelser efter de första 6 månadernas behandling med en given dos.
Det rekommenderas att leverfunktionstester utförs innan behandlingen påbörjas och därefter när det är kliniskt indicerat. Det har förekommit sällsynta rapporter efter marknadsföringen av fatal och icke-fatal leversvikt hos patienter som tar statiner, inklusive simvastatin. Om allvarlig leverskada med kliniska symtom och/eller hyperbilirubinemi eller gulsot inträffar under behandling med ZOCOR 5 mg, avbryt behandlingen omedelbart. Om en alternativ etiologi inte hittas, starta inte om ZOCOR. Observera att ALT kan komma från muskler, därför kan ALT som stiger med CK indikera myopati [se Myopati/Rabdomyolys ].
Läkemedlet bör användas med försiktighet till patienter som konsumerar betydande mängder alkohol och/eller har tidigare haft leversjukdom. Aktiva leversjukdomar eller oförklarade transaminashöjningar är kontraindikationer för användning av simvastatin.
Måttliga (mindre än 3X ULN) förhöjningar av serumtransaminaser har rapporterats efter behandling med simvastatin. Dessa förändringar uppträdde kort efter påbörjad behandling med simvastatin, var ofta övergående, åtföljdes inte av några symtom och krävde inget avbrott i behandlingen.
Endokrin funktion
Ökning av HbA1c och fastande serumglukosnivåer har rapporterats med HMG-CoA-reduktashämmare, inklusive ZOCOR.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
en 72-veckors karcinogenicitetsstudie fick möss dagliga doser av simvastatin på 25, 100 och 400 mg/kg kroppsvikt, vilket resulterade i genomsnittliga plasmaläkemedelsnivåer cirka 1, 4 och 8 gånger högre än medelvärdet för humant plasmaläkemedel. nivå (som total hämmande aktivitet baserat på AUC) efter en 80 mg oral dos. Leverkarcinom ökade signifikant hos kvinnor med höga doser och män i medel- och högdos med en maximal incidens på 90 % hos män. Incidensen av adenom i levern ökade signifikant hos kvinnor med medel- och högdos. Läkemedelsbehandling ökade också signifikant förekomsten av lungadenom hos män och kvinnor med medel- och högdos. Adenom i Harderian körteln (en körtel i ögat hos gnagare) var signifikant högre hos högdosmöss än hos kontroller. Inga tecken på en tumörframkallande effekt observerades vid 25 mg/kg/dag.
en separat 92-veckors karcinogenicitetsstudie på möss i doser upp till 25 mg/kg/dag observerades inga tecken på en tumörframkallande effekt (genomsnittliga plasmanivåer av läkemedel var 1 gånger högre än människor som fick 80 mg simvastatin mätt som AUC).
I en tvåårig studie på råttor med 25 mg/kg/dag sågs en statistiskt signifikant ökning av förekomsten av follikulära sköldkörteladenom hos honråttor exponerade för cirka 11 gånger högre nivåer av simvastatin än hos människor som fick 80 mg simvastatin (som mätt med AUC).
En andra tvåårig karcinogenicitetsstudie på råtta med doser på 50 och 100 mg/kg/dag gav hepatocellulära adenom och karcinom (hos honråttor vid båda doserna och hos hanar vid 100 mg/kg/dag). Sköldkörtelfollikulära celladenom ökade hos män och kvinnor vid båda doserna; Sköldkörtelfollikulära cellkarcinom ökade hos kvinnor med 100 mg/kg/dag. Den ökade förekomsten av sköldkörtelneoplasmer verkar överensstämma med fynd från andra statiner. Dessa behandlingsnivåer representerade plasmaläkemedelsnivåer (AUC) på cirka 7 och 15 gånger (män) och 22 och 25 gånger (kvinnor) den genomsnittliga humana plasmaläkemedelsexponeringen efter en daglig dos på 80 milligram.
Inga tecken på mutagenicitet observerades i ett mikrobiell mutagenicitetstest (Ames) med eller utan metabolisk aktivering av rått- eller muslever. Dessutom noterades inga tecken på skada på genetiskt material i en alkalisk elueringsanalys in vitro med råtthepatocyter, en V-79-studie av däggdjursceller framåtmutation, en kromosomavvikelsestudie in vitro i CHO-celler eller en kromosomavvikelseanalys in vivo i benmärg hos mus.
Det fanns minskad fertilitet hos hanråttor som behandlats med simvastatin under 34 veckor vid 25 mg/kg kroppsvikt (4 gånger den maximala humana exponeringsnivån, baserat på AUC, hos patienter som fick 80 mg/dag); denna effekt observerades dock inte under en efterföljande fertilitetsstudie där simvastatin administrerades med samma dosnivå till hanråttor under 11 veckor (hela cykeln av spermatogenes inklusive epididymal mognad). Inga mikroskopiska förändringar observerades i testiklarna på råttor från någon av studierna. Vid 180 mg/kg/dag, (vilket ger exponeringsnivåer 22 gånger högre än de hos människor som tar 80 mg/dag baserat på yta, mg/m2), observerades seminiferös tubulidegeneration (nekros och förlust av spermatogent epitel). Hos hundar förekom läkemedelsrelaterad testikelatrofi, minskad spermatogenes, spermatocytisk degeneration och jättecellsbildning vid 10 mg/kg/dag, (ungefär 2 gånger den mänskliga exponeringen, baserat på AUC, vid 80 mg/dag). Den kliniska betydelsen av dessa fynd är oklar.
Användning i specifika populationer
Graviditet
Graviditetskategori X [Se KONTRAINDIKATIONER ]
ZOCOR är kontraindicerat för kvinnor som är eller kan bli gravida. Lipidsänkande läkemedel ger ingen fördel under graviditeten, eftersom kolesterol och kolesterolderivat behövs för normal fosterutveckling. Åderförkalkning är en kronisk process, och utsättande av lipidsänkande läkemedel under graviditet bör ha liten inverkan på långsiktiga resultat av primär hyperkolesterolemibehandling. Det finns inga adekvata och välkontrollerade studier av användning med ZOCOR under graviditet; dock finns det sällsynta rapporter om medfödda anomalier hos spädbarn som exponerats för statiner i livmodern. Djurreproduktionsstudier av simvastatin på råttor och kaniner visade inga tecken på teratogenicitet. Serumkolesterol och triglycerider ökar under normal graviditet, och kolesterol eller kolesterolderivat är avgörande för fostrets utveckling. Eftersom statiner minskar kolesterolsyntesen och möjligen syntesen av andra biologiskt aktiva substanser som härrör från kolesterol, kan ZOCOR orsaka fosterskador när det administreras till en gravid kvinna. Om ZOCOR 5mg används under graviditet eller om patienten blir gravid medan du tar detta läkemedel, ska patienten informeras om den potentiella faran för fostret.
Det finns sällsynta rapporter om medfödda anomalier efter intrauterin exponering för statiner. I en granskning2 av cirka 100 prospektivt följda graviditeter hos kvinnor som exponerats för simvastatin eller annat strukturellt relaterat statin, översteg inte incidensen av medfödda anomalier, spontana aborter och fosterdöd/dödfödsel de förväntade i den allmänna befolkningen. Studien kunde dock endast utesluta en 3- till 4-faldigt ökad risk för medfödda anomalier jämfört med bakgrundsfrekvensen. I 89 % av dessa fall inleddes läkemedelsbehandling före graviditeten och avbröts under den första trimestern när graviditet identifierades.
Simvastatin var inte teratogent hos råttor eller kaniner vid doser (25 respektive 10 mg/kg/dag) som resulterade i 3 gånger den mänskliga exponeringen baserat på mg/m2 yta. I studier med en annan strukturrelaterad statin observerades dock skelettmissbildningar hos råttor och möss.
Manson, JM, Freyssinges, C., Ducrocq, MB, Stephenson, WP, Postmarketing Surveillance of Lovastatin and Simvastatin Exposure Under Pregnancy, Reproductive Toxicology, 10(6):439-446, 1996.
Kvinnor i fertil ålder, som behöver behandling med ZOCOR 5 mg för en lipidrubbning, bör rådas att använda effektiv preventivmedel. För kvinnor som försöker bli gravida bör utsättning av ZOCOR övervägas. Om graviditet inträffar ska ZOCOR omedelbart avbrytas.
Ammande mödrar
Det är inte känt om simvastatin utsöndras i modersmjölk. Eftersom en liten mängd av ett annat läkemedel i denna klass utsöndras i modersmjölk och på grund av risken för allvarliga biverkningar hos ammande spädbarn, bör kvinnor som tar simvastatin inte amma sina spädbarn. Ett beslut bör fattas om man ska avbryta amningen eller avbryta läkemedlet, med hänsyn till läkemedlets betydelse för modern [se KONTRAINDIKATIONER ].
Pediatrisk användning
Säkerhet och effektivitet av simvastatin hos patienter i åldern 10-17 år med heterozygot familjär hyperkolesterolemi har utvärderats i en kontrollerad klinisk prövning med pojkar och flickor som var minst 1 år efter menarken. Patienter som behandlades med simvastatin hade en biverkningsprofil som liknade den hos patienter som behandlades med placebo. Doser större än 40 mg har inte studerats i denna population. I denna begränsade kontrollerade studie fanns det ingen signifikant effekt på tillväxt eller sexuell mognad hos ungdomar hos pojkar eller flickor, eller på menstruationscykelns längd hos flickor. [Ser DOSERING OCH ADMINISTRERING , NEGATIVA REAKTIONER , Kliniska studier ] Tonåriga kvinnor bör rådas om lämpliga preventivmetoder under simvastatinbehandling [se KONTRAINDIKATIONER och Graviditet ]. Simvastatin har inte studerats hos patienter yngre än 10 år och inte heller hos premenarkala flickor.
Geriatrisk användning
Av de 2 423 patienter som fick ZOCOR 5 mg i kliniska fas III-studier och de 10 269 patienterna i hjärtskyddsstudien som fick ZOCOR 40 mg, var 363 (15 %) respektive 5 366 (52 %) ≥65 år gamla. I HPS var 615 (6%) ≥75 år gamla. Inga övergripande skillnader i säkerhet eller effektivitet observerades mellan dessa försökspersoner och yngre försökspersoner, och annan rapporterad klinisk erfarenhet har inte identifierat skillnader i svar mellan äldre och yngre patienter, men större känslighet hos vissa äldre individer kan inte uteslutas. Eftersom hög ålder (≥65 år) är en predisponerande faktor för myopati, bör ZOCOR förskrivas med försiktighet till äldre. [Ser KLINISK FARMAKOLOGI ]
En farmakokinetisk studie med simvastatin visade att den genomsnittliga plasmanivån av statinaktivitet var cirka 45 % högre hos äldre patienter mellan 70-78 år jämfört med patienter mellan 18-30 år. I 4S var 1 021 (23 %) av 4 444 patienter 65 år eller äldre. Lipidsänkande effekt var minst lika stor hos äldre patienter jämfört med yngre patienter, och ZOCOR minskade signifikant total mortalitet och CHD-mortalitet hos äldre patienter med en historia av CHD. I HPS var 52 % av patienterna äldre (4 891 patienter 65-69 år och 5 806 patienter 70 år eller äldre). De relativa riskminskningarna för CHD-död, icke-dödlig hjärtinfarkt, koronar och icke-koronar revaskulariseringsprocedurer och stroke var liknande hos äldre och yngre patienter [se Kliniska studier ]. I HPS, bland 32 145 patienter som gick in i den aktiva inkörningsperioden, fanns det 2 fall av myopati/rabdomyolys; dessa patienter var 67 och 73 år gamla. Av de 7 fallen av myopati/rabdomyolys bland 10 269 patienter som tilldelats simvastatin, var 4 65 år eller äldre (vid baslinjen), varav ett var över 75. Det fanns inga övergripande skillnader i säkerhet mellan äldre och yngre patienter i antingen 4S eller HPS.
Eftersom hög ålder (≥65 år) är en predisponerande faktor för myopati, inklusive rabdomyolys, bör ZOCOR 40 mg förskrivas med försiktighet till äldre. I en klinisk prövning av patienter som behandlades med simvastatin 80 mg/dag hade patienter ≥65 år en ökad risk för myopati, inklusive rabdomyolys, jämfört med patienter VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och KLINISK FARMAKOLOGI ]
Nedsatt njurfunktion
Försiktighet bör iakttas när ZOCOR 20 mg ges till patienter med gravt nedsatt njurfunktion.[Se DOSERING OCH ADMINISTRERING ]
Nedsatt leverfunktion
ZOCOR 10 mg är kontraindicerat till patienter med aktiv leversjukdom som kan inkludera oförklarliga ihållande förhöjningar av levertransaminasnivåer [se KONTRAINDIKATIONER och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Kinesiska patienter
I en klinisk prövning där patienter med hög risk för kardiovaskulär sjukdom behandlades med simvastatin 40 mg/dag (medianuppföljning 3,9 år), var incidensen av myopati cirka 0,05 % för icke-kinesiska patienter (n=7367) jämfört med 0,24 % för kinesiska patienter (n=5468). Incidensen av myopati för kinesiska patienter som fick simvastatin 40 mg/dag eller ezetimib/simvastatin 10/40 mg/dag samtidigt med niacin med förlängd frisättning 2 g/dag var 1,24 %.
Kinesiska patienter kan löpa högre risk för myopati, övervaka patienterna på lämpligt sätt. Samtidig administrering av ZOCOR 10mg med lipidmodifierande doser (≥1 g/dag niacin) av niacininnehållande produkter rekommenderas inte till kinesiska patienter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , LÄKEMEDELSINTERAKTIONER ].
ÖVERDOS
Signifikant dödlighet observerades hos möss efter en oral engångsdos på 9 g/m2. Inga tecken på dödlighet observerades hos råttor eller hundar som behandlats med doser på 30 respektive 100 g/m2. Inga specifika diagnostiska tecken observerades hos gnagare. Vid dessa doser var de enda tecknen som sågs hos hundar emes och slemhinneavföring.
Ett fåtal fall av överdosering med ZOCOR har rapporterats; den maximala dosen som togs var 3,6 g. Alla patienter tillfrisknade utan följdsjukdomar. Understödjande åtgärder bör vidtas i händelse av en överdos. Dialyserbarheten av simvastatin och dess metaboliter hos människa är för närvarande inte känd.
KONTRAINDIKATIONER
ZOCOR 40 mg är kontraindicerat under följande tillstånd:
- Samtidig administrering av starka CYP3A4-hämmare (t.ex. itrakonazol, ketokonazol, posakonazol, vorikonazol, HIV-proteashämmare, boceprevir, telaprevir, erytromycin, klaritromycin, telitromycin, nefazodon och kobicistat-innehållande produkter) VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Samtidig administrering av gemfibrozil, ciklosporin eller danazol [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Överkänslighet mot någon komponent i detta läkemedel [se NEGATIVA REAKTIONER ].
- Aktiv leversjukdom, som kan innefatta oförklarliga ihållande förhöjningar av levertransaminasnivåer [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Kvinnor som är gravida eller kan bli gravida. Serumkolesterol och triglycerider ökar under normal graviditet, och kolesterol eller kolesterolderivat är avgörande för fostrets utveckling. Eftersom HMG-CoA-reduktashämmare (statiner) minskar kolesterolsyntesen och möjligen syntesen av andra biologiskt aktiva substanser som härrör från kolesterol, kan ZOCOR 40mg orsaka fosterskada när det administreras till en gravid kvinna. Åderförkalkning är en kronisk process och utsättande av lipidsänkande läkemedel under graviditet bör ha liten inverkan på resultatet av långtidsbehandling av primär hyperkolesterolemi. Det finns inga adekvata och välkontrollerade studier av användning med ZOCOR under graviditet; Men i sällsynta rapporter observerades medfödda anomalier efter intrauterin exponering för statiner. I reproduktionsstudier på råtta och kanin visade simvastatin inga tecken på teratogenicitet. ZOCOR ska endast administreras till kvinnor i fertil ålder när det är högst osannolikt att sådana patienter blir gravida. Om patienten blir gravid medan du tar detta läkemedel, ska ZOCOR omedelbart avbrytas och patienten ska informeras om den potentiella faran för fostret [se Användning i specifika populationer ].
- Ammande mödrar. Det är inte känt om simvastatin utsöndras i modersmjölk; dock går en liten mängd av ett annat läkemedel i denna klass över i bröstmjölken. Eftersom statiner har potential för allvarliga biverkningar hos ammande spädbarn, bör kvinnor som behöver behandling med ZOCOR inte amma sina spädbarn [se Användning i specifika populationer ].
KLINISK FARMAKOLOGI
Handlingsmekanism
Simvastatin är en prodrug och hydrolyseras till sin aktiva β-hydroxisyraform, simvastatinsyra, efter administrering. Simvastatin är en specifik hämmare av 3-hydroxi-3-metylglutaryl-koenzym A (HMG-CoA) reduktas, enzymet som katalyserar omvandlingen av HMG-CoA till mevalonat, ett tidigt och hastighetsbegränsande steg i biosyntesvägen för kolesterol. Dessutom minskar simvastatin VLDL och TG och ökar HDL-C.
Farmakodynamik
Epidemiologiska studier har visat att förhöjda nivåer av total-C, LDL-C, såväl som minskade nivåer av HDL-C är associerade med utveckling av åderförkalkning och ökad kardiovaskulär risk. Att sänka LDL-C minskar denna risk. Den oberoende effekten av att höja HDL-C eller sänka TG på risken för koronar och kardiovaskulär sjuklighet och mortalitet har dock inte fastställts.
Farmakokinetik
Simvastatin är en lakton som lätt hydrolyseras in vivo till motsvarande β-hydroxisyra, en potent hämmare av HMG-CoA-reduktas. Hämning av HMG-CoA-reduktas är grunden för en analys i farmakokinetiska studier av β-hydroxisyrametaboliterna (aktiva hämmare) och, efter bashydrolys, aktiva plus latenta hämmare (totala hämmare) i plasma efter administrering av simvastatin.
Efter en oral dos av 14C-märkt simvastatin till människa utsöndrades 13 % av dosen i urin och 60 % i feces. Plasmakoncentrationer av total radioaktivitet (simvastatin plus 14C-metaboliter) nådde sin topp efter 4 timmar och sjönk snabbt till cirka 10 % av topp 12 timmar efter dosering. Eftersom simvastatin genomgår omfattande första-passage-extraktion i levern, är tillgängligheten av läkemedlet till den allmänna cirkulationen låg (
Både simvastatin och dess β-hydroxisyrametabolit är starkt bundna (cirka 95%) till humana plasmaproteiner. Råttstudier indikerar att när radiomärkt simvastatin administrerades passerade simvastatindividerad radioaktivitet blod-hjärnbarriären.
De huvudsakliga aktiva metaboliterna av simvastatin som finns i human plasma är β-hydroxisyran av simvastatin och dess 6'-hydroxi-, 6'-hydroximetyl- och 6'-exometylenderivat. Maximala plasmakoncentrationer av både aktiva och totala inhibitorer uppnåddes inom 1,3 till 2,4 timmar efter dosering. Även om det rekommenderade terapeutiska dosintervallet är 5 till 40 mg/dag, fanns det ingen väsentlig avvikelse från linjäriteten av AUC för hämmare i den allmänna cirkulationen med en dosökning till så hög som 120 mg. I förhållande till fastetillståndet påverkades inte plasmaprofilen för inhibitorer när simvastatin administrerades omedelbart innan en American Heart Association rekommenderade en måltid med låg fetthalt.
en studie som omfattade 16 äldre patienter mellan 70 och 78 år som fick ZOCOR 40 mg/dag, ökade den genomsnittliga plasmanivån av HMG-CoA-reduktashämmande aktivitet med cirka 45 % jämfört med 18 patienter mellan 18-30 år. Erfarenhet av kliniska studier på äldre (n=1522) tyder på att det inte fanns några övergripande skillnader i säkerhet mellan äldre och yngre patienter [se Användning i specifika populationer ].
Kinetiska studier med en annan statin, som har en liknande huvudsaklig elimineringsväg, har antytt att för en given dosnivå kan högre systemisk exponering uppnås hos patienter med allvarlig njurinsufficiens (mätt som kreatininclearance).
Simvastatinsyra är ett substrat för transportproteinet OATP1B1. Samtidig administrering av läkemedel som är hämmare av transportproteinet OATP1B1 kan leda till ökade plasmakoncentrationer av simvastatinsyra och en ökad risk för myopati. Till exempel har ciklosporin visats öka AUC för statiner; Även om mekanismen inte är helt klarlagd, beror ökningen av AUC för simvastatinsyra förmodligen delvis på hämning av CYP3A4 och/eller OATP1B1.
Risken för myopati ökar av höga nivåer av HMG-CoA-reduktashämmande aktivitet i plasma. Hämmare av CYP3A4 kan höja plasmanivåerna av HMG-CoA-reduktashämmande aktivitet och öka risken för myopati [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och LÄKEMEDELSINTERAKTIONER ].
en studie med 12 friska frivilliga, hade simvastatin i dosen 80 mg ingen effekt på metabolismen av proben cytokrom P450 isoform 3A4 (CYP3A4) substrat midazolam och erytromycin. Detta indikerar att simvastatin inte är en hämmare av CYP3A4 och därför inte förväntas påverka plasmanivåerna av andra läkemedel som metaboliseras av CYP3A4.
Samtidig administrering av simvastatin (40 mg dagligen i 10 dagar) resulterade i en ökning av de maximala medelnivåerna av kardioaktivt digoxin (given som en engångsdos på 0,4 mg på dag 10) med cirka 0,3 ng/ml.
Djurtoxikologi och/eller farmakologi
CNS-toxicitet
Synnervens degeneration sågs hos kliniskt normala hundar som behandlats med simvastatin i 14 veckor vid 180 mg/kg/dag, en dos som gav medelvärde av läkemedelsnivåer i plasma cirka 12 gånger högre än medelvärdeplasmaläkemedelsnivån hos människor som tog 80 mg/dag.
Ett kemiskt liknande läkemedel i denna klass orsakade också degeneration av synnerven (Wallerian degeneration av retinogene fibrer) hos kliniskt normala hundar på ett dosberoende sätt med början på 60 mg/kg/dag, en dos som gav genomsnittliga läkemedelsnivåer i plasma cirka 30 gånger högre än den genomsnittliga plasmaläkemedelsnivån hos människor som tar den högsta rekommenderade dosen (mätt som total enzymhämmande aktivitet). Samma läkemedel producerade också vestibulocochlear Wallerian-liknande degeneration och retinal ganglioncellskromatolys hos hundar som behandlats i 14 veckor med 180 mg/kg/dag, en dos som resulterade i en genomsnittlig plasmaläkemedelsnivå som liknar den som ses med 60 mg/kg/ dagsdos.
CNS-kärlskador, karakteriserade av perivaskulär blödning och ödem, mononukleär cellinfiltration av perivaskulära utrymmen, perivaskulära fibrinavlagringar och nekros av små kärl sågs hos hundar som behandlats med simvastatin i en dos på 360 mg/kg/dag, en dos som producerade medelplasma läkemedelsnivåer som var cirka 14 gånger högre än de genomsnittliga plasmanivåerna av läkemedel hos människor som tog 80 mg/dag. Liknande CNS-kärlskador har observerats med flera andra läkemedel av denna klass.
Det förekom grå starr hos honråttor efter två års behandling med 50 och 100 mg/kg/dag (22 respektive 25 gånger human AUC vid 80 mg/dag) och hos hundar efter tre månader med 90 mg/kg/dag ( 19 gånger) och vid två år vid 50 mg/kg/dag (5 gånger).
Kliniska studier
Kliniska studier hos vuxna
Minskad risk för CHD-dödlighet och kardiovaskulära händelser
4S utvärderades effekten av behandling med ZOCOR 20 mg på total dödlighet hos 4 444 patienter med CHD och totalkolesterol vid baseline 212-309 mg/dL (5,5-8,0 mmol/L). I denna multicenter, randomiserade, dubbelblinda, placebokontrollerade studie, behandlades patienter med standardvård, inklusive diet, och antingen ZOCOR 20-40 mg/dag (n=2 221) eller placebo (n=2 223) under en medianvaraktighet på 5,4 år. Under studiens gång ledde behandling med ZOCOR till en genomsnittlig minskning av total-C, LDL-C och TG med 25 %, 35 % respektive 10 %, och en genomsnittlig ökning av HDL-C på 8 %. ZOCOR minskade signifikant risken för dödlighet med 30 % (p=0,0003, 182 dödsfall i ZOCOR 40 mg-gruppen mot 256 dödsfall i placebogruppen). Risken för CHD-dödlighet minskade signifikant med 42 % (p=0,00001, 111 vs 189 dödsfall). Det fanns ingen statistiskt signifikant skillnad mellan grupper i icke-kardiovaskulär mortalitet. ZOCOR minskade signifikant risken för allvarliga kranskärlshändelser (CHD-mortalitet plus sjukhusverifierad och tyst icke-fatal hjärtinfarkt [MI]) med 34 % (p
Hjärtskyddsstudien (HPS) var en stor, multicenter, placebokontrollerad, dubbelblind studie med en genomsnittlig varaktighet på 5 år utförd på 20 536 patienter (10 269 på ZOCOR 40 mg och 10 267 på placebo). Patienterna tilldelades behandling med hjälp av en kovariat adaptiv metod3 som tog hänsyn till fördelningen av 10 viktiga baslinjekarakteristika för patienter som redan var inskrivna och minimerade obalansen mellan dessa egenskaper mellan grupperna. Patienterna hade en medelålder på 64 år (intervall 40-80 år), var 97 % kaukasiska och hade hög risk att utveckla en allvarlig kranskärlshändelse på grund av existerande CHD (65 %), diabetes (typ 2, 26 %; typ 1 , 3 %), anamnes på stroke eller annan cerebrovaskulär sjukdom (16 %), perifer kärlsjukdom (33 %) eller hypertoni hos män ≥65 år (6 %). Vid baslinjen hade 3 421 patienter (17 %) LDL-C-nivåer under 100 mg/dL, av vilka 953 (5 %) hade LDL-C-nivåer under 80 mg/dL; 7 068 patienter (34 %) hade nivåer mellan 100 och 130 mg/dL; och 10 047 patienter (49 %) hade nivåer högre än 130 mg/dL.
DR Taves, minimering: en ny metod för att tilldela patienter till behandlings- och kontrollgrupper. Clin. Pharmacol. Ther. 15 (1974), sid. 443-453
HPS-resultaten visade att ZOCOR 40 mg/dag signifikant minskade: total och CHD mortalitet; icke-dödlig hjärtinfarkt, stroke och revaskulariseringsprocedurer (koronar och icke-koronar) (se tabell 4).
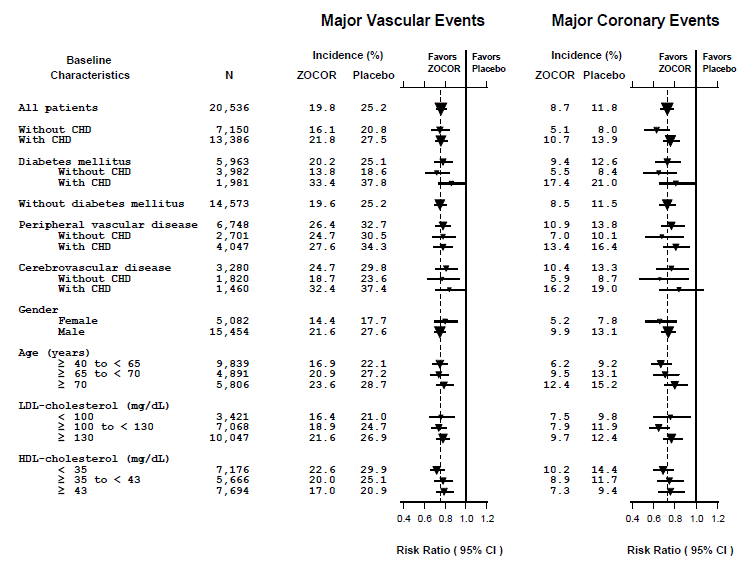
Två sammansatta effektmått definierades för att ha tillräckliga händelser för att bedöma relativa riskminskningar över en rad baslinjeegenskaper (se figur 1). En sammansättning av allvarliga kranskärlshändelser (MCE) bestod av CHD-mortalitet och icke-dödlig hjärtinfarkt (analyserad efter tid till första händelse; 898 patienter behandlade med ZOCOR 5 mg hade händelser och 1 212 patienter på placebo hade händelser). En sammansättning av stora vaskulära händelser (MVE) bestod av MCE, stroke och revaskulariseringsprocedurer inklusive kranskärls-, perifera och andra icke-koronaringrepp (analyserade av tid till första händelse; 2 033 patienter behandlade med ZOCOR 10 mg hade händelser och 2 585 patienter på placebo hade händelser). Signifikanta relativa riskminskningar observerades för båda sammansatta effektmåtten (27 % för MCE och 24 % för MVE, p
Figur 1 Effekterna av behandling med ZOCOR 5mg på större vaskulära händelser och stora kranskärlshändelser i HPS
Angiografiska studier
I Multicenter Anti-Atheroma Study utvärderades effekten av simvastatin på ateroskleros genom kvantitativ kranskärlsangiografi hos hyperkolesterolemiska patienter med CHD. I denna randomiserade, dubbelblinda, kontrollerade studie behandlades patienter med simvastatin 20 mg/dag eller placebo. Angiogram utvärderades vid baslinjen, två och fyra år. De co-primära studiens ändpunkter var genomsnittlig förändring per patient i minsta och genomsnittliga lumendiametrar, vilket indikerar fokal respektive diffus sjukdom. ZOCOR bromsade signifikant progressionen av lesioner, mätt i år 4-angiogrammet med båda parametrarna, såväl som genom förändring i procentuell diameterstenos. Dessutom minskade simvastatin signifikant andelen patienter med nya lesioner och med nya totala ocklusioner.
Modifieringar av lipidprofiler
Primär hyperlipidemi (Fredrickson typ lla och llb)
ZOCOR har visat sig vara effektivt för att reducera total-C och LDL-C vid heterozygot familjär och icke-familiella former av hyperlipidemi och vid blandad hyperlipidemi. Maximalt till nästan maximalt svar uppnås vanligtvis inom 4-6 veckor och bibehålls under kronisk behandling. ZOCOR minskade signifikant total-C, LDL-C, total-C/HDL-C ratio och LDL-C/HDL-C ratio; ZOCOR minskade också TG och ökade HDL-C (se tabell 5).
Hypertriglyceridemi (Fredrickson typ lV)
Resultaten av en undergruppsanalys på 74 patienter med typ lV-hyperlipidemi från en dubbelblind, placebokontrollerad, 3-periods övergångsstudie med 130 patienter presenteras i tabell 6.
Dysbetalipoproteinemi (Fredrickson typ III)
Resultaten av en subgruppsanalys hos 7 patienter med typ ll-hyperlipidemi (dysbetalipoproteinemi) (apo E2/2) (VLDL-C/TG>0,25) från en dubbelblind, placebokontrollerad, 3-periods crossover-studie med 130 patienter presenteras i tabell 7.
Homozygot familjär hyperkolesterolemi
I en kontrollerad klinisk studie fick 12 patienter 15-39 år med homozygot familjär hyperkolesterolemi simvastatin 40 mg/dag i en singeldos eller i 3 uppdelade doser, eller 80 mg/dag i 3 uppdelade doser. Hos 11 patienter med sänkningar av LDL-C var de genomsnittliga LDL-C-förändringarna för doserna 40 och 80 mg 14 % (intervall 8 % till 23 %, median 12 %) och 30 % (intervall 14 % till 46 % , median 29 %), respektive. En patient hade en ökning av LDL-C med 15 %. En annan patient med frånvarande LDL-C-receptorfunktion hade en LDL-C-reduktion på 41 % med dosen på 80 mg.
Endokrin funktion
kliniska studier försämrade simvastatin inte binjurebarken eller minskade signifikant basal plasmakortisolkoncentration. Små minskningar från basal plasmatestosteron hos män observerades i kliniska studier med simvastatin, en effekt som även observerades med andra statiner och gallsyrabindaren kolestyramin. Det fanns ingen effekt på plasmagonadotropinnivåerna. I en placebokontrollerad, 12-veckors studie sågs ingen signifikant effekt av simvastatin 80 mg på plasmatestosteronsvaret på humant koriongonadotropin. I en annan 24-veckors studie hade simvastatin 20-40 mg ingen detekterbar effekt på spermatogenesen. I 4S, där 4 444 patienter randomiserades till simvastatin 20-40 mg/dag eller placebo under en medianduration på 5,4 år, var incidensen av sexuella biverkningar hos män i de två behandlingsgrupperna inte signifikant olika. På grund av dessa faktorer är det osannolikt att de små förändringarna i plasmatestosteron är kliniskt signifikanta. Eventuella effekter på hypofys-gonadala axeln hos pre-menopausala kvinnor är okända.
Kliniska studier hos ungdomar
I en dubbelblind, placebokontrollerad studie randomiserades 175 patienter (99 tonårspojkar och 76 postmenarkala flickor) 10-17 år (medelålder 14,1 år) med heterozygot familjär hyperkolesterolemi (HeFH) till simvastatin (n= 106) eller placebo (n=67) i 24 veckor (basstudie). Inkludering i studien krävde en baslinjenivå av LDL-C mellan 160 och 400 mg/dL och minst en förälder med en LDL-C-nivå >189 mg/dL. Doseringen av simvastatin (en gång dagligen på kvällen) var 10 mg under de första 8 veckorna, 20 mg under de andra 8 veckorna och 40 mg därefter. I en 24-veckors förlängning valde 144 patienter att fortsätta behandlingen med simvastatin 40 mg eller placebo.
ZOCOR 20 mg minskade signifikant plasmanivåerna av total-C, LDL-C och Apo B (se tabell 8). Resultaten från förlängningen efter 48 veckor var jämförbara med de som observerades i basstudien.
Efter 24 veckors behandling var det genomsnittliga LDL-C-värdet 124,9 mg/dL (intervall: 64,0289,0 mg/dL) i ZOCOR 40 mg-gruppen jämfört med 207,8 mg/dL (intervall: 128,0-334,0 mg/dL) i placebogruppen.
Säkerheten och effekten av doser över 40 mg dagligen har inte studerats hos barn med HeFH. Den långsiktiga effekten av simvastatinbehandling i barndomen för att minska sjuklighet och mortalitet i vuxen ålder har inte fastställts.
PATIENTINFORMATION
Patienter bör rådas att följa deras rekommenderade kost för National Cholesterol Education Program (NCEP), ett regelbundet träningsprogram och regelbundna tester av en fastande lipidpanel.
Patienter bör informeras om substanser som de inte bör ta samtidigt med simvastatin [ser KONTRAINDIKATIONER och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Patienter bör också rådas att informera annan vårdpersonal som förskriver ett nytt läkemedel eller ökar dosen av ett befintligt läkemedel om att de tar ZOCOR.
Träningsvärk
Alla patienter som påbörjar behandling med ZOCOR ska informeras om risken för myopati, inklusive rabdomyolys, och uppmanas att omedelbart rapportera all oförklarlig muskelsmärta, ömhet eller svaghet, särskilt om de åtföljs av sjukdomskänsla eller feber eller om dessa muskeltecken eller symtom kvarstår efter avslutad behandling med ZOCOR. Patienter som använder dosen 80 mg bör informeras om att risken för myopati, inklusive rabdomyolys, ökar vid användning av dosen 80 mg. Risken för myopati, inklusive rabdomyolys, som uppstår vid användning av ZOCOR 40 mg ökar när du tar vissa typer av medicin eller konsumerar grapefruktjuice. Patienter bör diskutera all medicinering, både receptbelagd och över disk, med sin vårdpersonal.
Leverenzymer
Det rekommenderas att leverfunktionstester utförs innan ZOCOR 20 mg påbörjas och därefter när det är kliniskt indicerat. Alla patienter som behandlas med ZOCOR bör rådas att omedelbart rapportera alla symtom som kan tyda på leverskada, inklusive trötthet, anorexi, obehag i övre högra delen av buken, mörk urin eller gulsot.
Graviditet
Kvinnor i fertil ålder bör rådas att använda en effektiv preventivmetod för att förhindra graviditet medan de använder ZOCOR. Diskutera framtida graviditetsplaner med dina patienter och diskutera när de ska sluta ta ZOCOR 40 mg om de försöker bli gravida. Patienter ska informeras om att om de blir gravida ska de sluta ta ZOCOR och ringa sin läkare.
Amning
Kvinnor som ammar ska inte använda ZOCOR. Patienter som har en lipidrubbning och ammar bör rådas att diskutera alternativen med sin läkare.
