Zetia 10mg Ezetimibe Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Zetia och hur används det?
Zetia är ett receptbelagt läkemedel som används för att behandla symtom på högt kolesterol och för att minska kolesterolet. Zetia kan användas ensamt eller tillsammans med andra läkemedel.
Zetia tillhör en klass av läkemedel som kallas lipidsänkande medel, 2-azetidinoner.
Det är inte känt om Zetia 10 mg är säkert och effektivt för barn yngre än 10 år.
Vilka är de möjliga biverkningarna av Zetia?
Zetia kan orsaka allvarliga biverkningar inklusive:
- träningsvärk,
- muskelömhet eller svaghet,
- feber,
- ovanlig trötthet, och
- mörkfärgad urin
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Zetia 10mg inkluderar:
- muskel- eller ledvärk,
- Täppt i näsan,
- sinus smärta,
- öm hals,
- diarré och
- smärta i en arm eller ben
Tala om för din läkare om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Zetia. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
ZETIA (ezetimib) tillhör en klass av lipidsänkande föreningar som selektivt hämmar tarmabsorptionen av kolesterol och relaterade fytosteroler. Det kemiska namnet på ezetimib är 1-(4-fluorfenyl)-3(R)-[3-(4-fluorfenyl)-3(S)-hydroxipropyl]-4(S)-(4-hydroxifenyl)-2-azetidinon . Den empiriska formeln är C24H21F2NO3. Dess molekylvikt är 409,4 och dess strukturformel är:
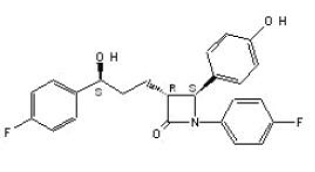
Ezetimib är ett vitt, kristallint pulver som är fritt till mycket lösligt i etanol, metanol och aceton och praktiskt taget olösligt i vatten. Ezetimib har en smältpunkt på cirka 163°C och är stabil vid rumstemperatur. ZETIA 10mg finns som en tablett för oral administrering innehållande 10 mg ezetimib och följande inaktiva ingredienser: kroskarmellosnatrium NF, laktosmonohydrat NF, magnesiumstearat NF, mikrokristallin cellulosa NF, povidon USP och natriumlaurylsulfat NF.
INDIKATIONER
Terapi med lipidförändrande medel bör endast vara en komponent i multipel riskfaktorintervention hos individer med signifikant ökad risk för aterosklerotisk kärlsjukdom på grund av hyperkolesterolemi. Läkemedelsbehandling är indicerat som ett komplement till kosten när svaret på en diet begränsad i mättat fett och kolesterol och andra icke-farmakologiska åtgärder enbart har varit otillräckligt.
Primär hyperlipidemi
Monoterapi
ZETIA®, administrerat ensamt, är indicerat som tilläggsterapi till kosten för att minska förhöjt totalkolesterol (total-C), lågdensitetslipoproteinkolesterol (LDL-C), apolipoprotein B (Apo B) och icke-högdensitetslipoproteinkolesterol (icke-HDL-C) hos patienter med primär (heterozygot familjär och icke-familiell) hyperlipidemi.
Kombinationsterapi med HMG-CoA-reduktashämmare (statiner)
ZETIA 10 mg, administrerat i kombination med en 3-hydroxi-3-metylglutaryl-koenzym A (HMG-CoA) reduktashämmare (statin), är indicerat som tilläggsbehandling till diet för att minska förhöjda total-C, LDL-C, Apo B och icke-HDL-C hos patienter med primär (heterozygot familjär och icke-familiell) hyperlipidemi.
Kombinationsterapi med fenofibrat
ZETIA 10 mg, administrerat i kombination med fenofibrat, är indicerat som tilläggsterapi till dieten för att minska förhöjda total-C, LDL-C, Apo B och icke-HDL-C hos vuxna patienter med blandad hyperlipidemi.
Homozygot familjär hyperkolesterolemi (HoFH)
Kombinationen av ZETIA 10 mg och atorvastatin eller simvastatin är indicerat för att minska förhöjda total-C- och LDL-C-nivåer hos patienter med HoFH, som ett komplement till andra lipidsänkande behandlingar (t.ex. LDL-aferes) eller om sådana behandlingar inte är tillgängliga .
Homozygot sitosterolemi
ZETIA 10 mg är indicerat som tilläggsbehandling till dieten för att minska förhöjda sitosterol- och campesterolnivåer hos patienter med homozygot familjär sitosterolemi.
Användningsbegränsningar
Effekten av ZETIA på kardiovaskulär morbiditet och mortalitet har inte fastställts.
ZETIA har inte studerats vid Fredricksons dyslipidemier typ I, III, IV och V.
DOSERING OCH ADMINISTRERING
Allmän doseringsinformation
Den rekommenderade dosen av ZETIA är 10 mg en gång dagligen.
ZETIA 10 mg kan administreras med eller utan mat.
Samtidig lipidsänkande terapi
ZETIA 10 mg kan administreras med en statin (till patienter med primär hyperlipidemi) eller med fenofibrat (till patienter med blandad hyperlipidemi) för ökad effekt. För enkelhetens skull kan den dagliga dosen av ZETIA tas samtidigt med statin eller fenofibrat, enligt doseringsrekommendationerna för respektive läkemedel.
Coadminis med gallsyrabindare
Dosering av ZETIA bör ske antingen ≥2 timmar före eller ≥4 timmar efter administrering av ett gallsyrabindande medel [se LÄKEMEDELSINTERAKTIONER ].
Patienter med nedsatt leverfunktion
Ingen dosjustering är nödvändig hos patienter med lätt nedsatt leverfunktion [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Patienter med nedsatt njurfunktion
Ingen dosjustering är nödvändig hos patienter med nedsatt njurfunktion [se KLINISK FARMAKOLOGI ]. När det ges tillsammans med simvastatin till patienter med måttligt till gravt nedsatt njurfunktion (uppskattad glomerulär filtrationshastighet Användning i specifika populationer ].
Geriatriska patienter
Ingen dosjustering är nödvändig hos geriatriska patienter [se KLINISK FARMAKOLOGI ].
HUR LEVERERAS
Doseringsformer och styrkor
10 mg tabletter är vita till benvita, kapselformade tabletter präglade med ”414” på ena sidan.
Förvaring Och Hantering
nr 3861 - Tabletter ZETIA, 10 mg , är vita till benvita, kapselformade tabletter präglade med ”414” på ena sidan. De levereras enligt följande:
NDC 66582-414-31 flaskor med 30 st NDC 66582-414-54 flaskor à 90 st NDC 66582-414-74 flaskor à 500 stycken NDC 66582-414-76 flaskor à 5000 NDC 66582-414-28 enhetsdosförpackningar om 100 st.
Lagring
Förvara vid 25°C (77°F); utflykter tillåtna till 15-30°C (59-86°F). [Ser USP-kontrollerad rumstemperatur .] Skydda mot fukt.
Merck Sharp & Dohme Corp., ett dotterbolag till MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Reviderad: augusti 2013
BIEFFEKTER
Följande allvarliga biverkningar diskuteras mer i detalj i andra avsnitt av etiketten:
- Leverenzymavvikelser [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Rabdomyolys och myopati [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Monoterapistudier
ZETIA 10 mg databas för kontrollerade kliniska prövningar (placebokontrollerade) med 2396 patienter med en medianbehandlingstid på 12 veckor (intervall 0 till 39 veckor), avbröt 3,3 % av patienterna på ZETIA 10 mg och 2,9 % av patienterna på placebo på grund av biverkningar reaktioner. De vanligaste biverkningarna i gruppen patienter som behandlades med ZETIA 10 mg som ledde till att behandlingen avbröts och som inträffade i en högre frekvens än placebo var:
- Artralgi (0,3 %)
- Yrsel (0,2 %)
- Gamma-glutamyltransferas ökade (0,2 %)
De vanligaste rapporterade biverkningarna (incidens ≥2 % och högre än placebo) i ZETIAs monoterapidatabas med kontrollerade kliniska prövningar med 2396 patienter var: övre luftvägsinfektion (4,3 %), diarré (4,1 %), artralgi (3,0 %), bihåleinflammation (2,8 %) och smärta i extremiteter (2,7 %).
Studier av samtidig administrering av statiner
databasen för ZETIA + statinkontrollerade kliniska prövningar med 11 308 patienter med en medianbehandlingstid på 8 veckor (intervall 0 till 112 veckor), avbröt 4,0 % av patienterna på ZETIA + statin och 3,3 % av patienterna på enbart statin på grund av biverkningar. De vanligaste biverkningarna i gruppen patienter som behandlades med ZETIA + statin som ledde till att behandlingen avbröts och som inträffade i en frekvens som var högre än statin enbart var:
- Alaninaminotransferas ökade (0,6 %)
- Myalgi (0,5 %)
- Trötthet, ökad aspartataminotransferas, huvudvärk och smärta i extremiteter (var och en med 0,2 %)
De vanligaste rapporterade biverkningarna (incidens ≥2 % och högre än enbart statin) i ZETIA + statinkontrollerade kliniska prövningsdatabasen med 11 308 patienter var: nasofaryngit (3,7 %), myalgi (3,2 %), övre luftvägsinfektion (2,9 % ), artralgi (2,6%) och diarré (2,5%).
Erfarenhet av kliniska prövningar
Eftersom kliniska studier utförs under mycket varierande förhållanden, kan biverkningsfrekvenser som observerats i de kliniska studierna av ett läkemedel inte direkt jämföras med frekvensen i de kliniska studierna av ett annat läkemedel och återspeglar kanske inte frekvensen som observerats i klinisk praxis.
Monoterapi
I 10 dubbelblinda, placebokontrollerade kliniska prövningar, 2396 patienter med primär hyperlipidemi (åldersintervall 9-86 år, 50 % kvinnor, 90 % kaukasier, 5 % svarta, 3 % latinamerikaner, 2 % asiater) och förhöjt LDL-C behandlades med ZETIA 10 mg/dag under en medianbehandlingstid på 12 veckor (intervall 0 till 39 veckor).
Biverkningar som rapporterats hos ≥2 % av patienterna som behandlats med ZETIA och med en incidens som är högre än placebo i placebokontrollerade studier av ZETIA 10 mg, oavsett orsaksbedömning, visas i Tabell 1.
TABELL 1: Kliniska biverkningar som förekommer hos ≥2 % av patienterna som behandlas med ZETIA 10 mg och med en incidens som är högre än placebo, oavsett orsakssamband
Frekvensen av mindre vanliga biverkningar var jämförbar mellan ZETIA 10 mg och placebo.
Kombination med en statin
I 28 dubbelblinda, kontrollerade (placebo eller aktivkontrollerade) kliniska prövningar, 11 308 patienter med primär hyperlipidemi (åldersintervall 10-93 år, 48 % kvinnor, 85 % kaukasier, 7 % svarta, 4 % latinamerikaner, 3 % asiater) och förhöjt LDL-C behandlades med ZETIA 10 mg/dag samtidigt med eller tilläggs till pågående statinbehandling under en medianbehandlingstid på 8 veckor (intervall 0 till 112 veckor).
Incidensen av på varandra följande ökade transaminaser (≥3 × ULN) var högre hos patienter som fick ZETIA 10 mg administrerat med statiner (1,3 %) än hos patienter som behandlades med enbart statiner (0,4 %). [Ser VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Kliniska biverkningar som rapporterats hos ≥2 % av patienterna som behandlats med ZETIA + statin och med en incidens som är högre än statin, oavsett kausalitetsbedömning, visas i Tabell 2.
TABELL 2: Kliniska biverkningar som förekommer hos ≥2 % av patienterna som behandlats med ZETIA 10 mg tillsammans med en statin och med en incidens som är högre än statin, oavsett orsakssamband
Kombination med fenofibrat
Denna kliniska studie involverade 625 patienter med blandad dyslipidemi (åldersintervall 20-76 år, 44 % kvinnor, 79 % kaukasier, 0,1 % svarta, 11 % latinamerikaner, 5 % asiater) behandlade i upp till 12 veckor och 576 patienter behandlade i upp till ytterligare 48 veckor utvärderade samtidig administrering av ZETIA och fenofibrat. Denna studie var inte utformad för att jämföra behandlingsgrupper för sällsynta händelser. Incidensfrekvensen (95 % CI) för kliniskt viktiga förhöjningar (≥3 — ULN, konsekutiva) i levertransaminasnivåer var 4,5 % (1,9, 8,8) och 2,7 % (1,2, 5,4) för fenofibrat monoterapi (n=188) och ZETIA samtidigt administrerat med fenofibrat (n=183) respektive, justerat för behandlingsexponering. Motsvarande incidensfrekvens för kolecystektomi var 0,6 % (95 % KI: 0,0 %, 3,1 %) respektive 1,7 % (95 % KI: 0,6 %, 4,0 %) för fenofibrat monoterapi och ZETIA 10 mg samtidigt med fenofibrat [se LÄKEMEDELSINTERAKTIONER ]. Antalet patienter som exponerades för samtidig administreringsterapi samt fenofibrat och ezetimib monoterapi var otillräckligt för att bedöma risken för gallblåsan. Det fanns inga CPK-höjningar > 10 — ULN i någon av behandlingsgrupperna.
Erfarenhet efter marknadsföring
Eftersom reaktionerna nedan rapporteras frivilligt från en population av osäker storlek är det i allmänhet inte möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering.
Följande ytterligare biverkningar har identifierats efter användning av ZETIA efter godkännande:
Överkänslighetsreaktioner, inklusive anafylaxi, angioödem, hudutslag och urtikaria; erythema multiforme; artralgi; muskelvärk; förhöjt kreatinfosfokinas; myopati/rabdomyolys [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]; förhöjda levertransaminaser; hepatit; buksmärtor; trombocytopeni; pankreatit; illamående; yrsel; parestesi; depression; huvudvärk; kolelithiasis; kolecystit.
LÄKEMEDELSINTERAKTIONER
[Ser KLINISK FARMAKOLOGI ]
Cyklosporin
Försiktighet bör iakttas när ZETIA 10 mg och ciklosporin används samtidigt på grund av ökad exponering för både ezetimib och ciklosporin. Cyklosporinkoncentrationer bör övervakas hos patienter som får ZETIA och ciklosporin.
Graden av ökning av exponeringen för ezetimib kan vara högre hos patienter med allvarlig njurinsufficiens. Hos patienter som behandlas med ciklosporin bör de potentiella effekterna av den ökade exponeringen för ezetimib vid samtidig användning noggrant vägas mot fördelarna med förändringar i lipidnivåer som ezetimib ger.
Fibrater
Effekten och säkerheten vid samtidig administrering av ezetimib med andra fibrater än fenofibrat har inte studerats.
Fibrater kan öka kolesterolutsöndringen i gallan, vilket leder till kolelitiasis. I en preklinisk studie på hundar ökade ezetimib kolesterol i gallblåsan [se Icke-klinisk toxikologi ]. Samtidig administrering av ZETIA med andra fibrater än fenofibrat rekommenderas inte förrän användningen hos patienter har studerats tillräckligt.
Fenofibrat
Om kolelithiasis misstänks hos en patient som får ZETIA 10 mg och fenofibrat, är gallblåsstudier indicerade och alternativ lipidsänkande behandling bör övervägas [se NEGATIVA REAKTIONER och produktmärkningen för fenofibrat].
Kolestyramin
Samtidig administrering av kolestyramin minskade medelarean under kurvan (AUC) för totalt ezetimib med cirka 55 %. Den inkrementella minskningen av LDL-C på grund av tillsats av ezetimib till kolestyramin kan minskas av denna interaktion.
Kumarin antikoagulantia
Om ezetimib läggs till warfarin, ett kumarinantikoagulant, bör International Normalized Ratio (INR) övervakas på lämpligt sätt.
VARNINGAR
Ingår som en del av FÖRSIKTIGHETSÅTGÄRDER sektion.
FÖRSIKTIGHETSÅTGÄRDER
Använd med statiner eller fenofibrat
Samtidig administrering av ZETIA med ett specifikt statin eller fenofibrat bör vara i enlighet med produktmärkningen för det läkemedlet.
Leverenzymer
kontrollerade kliniska monoterapistudier var incidensen av på varandra följande förhöjningar (≥3 x den övre normalgränsen [ULN]) i levertransaminasnivåer liknande mellan ZETIA (0,5 %) och placebo (0,3 %).
I kontrollerade kliniska kombinationsstudier av ZETIA 10 mg inledda samtidigt med en statin, var incidensen av på varandra följande förhöjningar (≥3 x ULN) i levertransaminasnivåer 1,3 % för patienter som behandlades med ZETIA administrerade med statiner och 0,4 % för patienter som behandlades med enbart statiner. Dessa ökningar av transaminaser var i allmänhet asymtomatiska, inte associerade med kolestas och återgick till baslinjen efter avslutad behandling eller med fortsatt behandling. När ZETIA administreras samtidigt med en statin, bör levertester utföras i början av behandlingen och enligt statinets rekommendationer. Om en ökning av ALAT eller ASAT ≥3 x ULN kvarstår, överväg att utsätta ZETIA 10 mg och/eller statinet.
Myopati/Rabdomyolys
kliniska prövningar fanns det inget överskott av myopati eller rabdomyolys i samband med ZETIA 10 mg jämfört med den relevanta kontrollarmen (enbart placebo eller statin). Myopati och rabdomyolys är dock kända biverkningar av statiner och andra lipidsänkande läkemedel. I kliniska prövningar var incidensen av kreatinfosfokinas (CPK) > 10 x ULN 0,2 % för ZETIA mot 0,1 % för placebo, och 0,1 % för ZETIA administrerat samtidigt med en statin jämfört med 0,4 % för enbart statiner. Risken för skelettmuskeltoxicitet ökar med högre doser av statin, hög ålder (> 65), hypotyreos, nedsatt njurfunktion och, beroende på vilken statin som används, samtidig användning av andra läkemedel.
Efter godkännandet av ZETIA har fall av myopati och rabdomyolys rapporterats. De flesta patienter som utvecklade rabdomyolys tog ett statin innan ZETIA påbörjades. Rabdomyolys har dock rapporterats med ZETIA 10 mg monoterapi och med tillägg av ZETIA 10 mg till läkemedel som är kända för att vara associerade med ökad risk för rabdomyolys, såsom fibrater. ZETIA och eventuella statiner eller fibrater som patienten tar samtidigt ska omedelbart avbrytas om myopati diagnostiseras eller misstänks. Förekomsten av muskelsymtom och en CPK-nivå > 10 x ULN indikerar myopati.
Nedsatt leverfunktion
På grund av de okända effekterna av den ökade exponeringen för ezetimib hos patienter med måttligt till gravt nedsatt leverfunktion, rekommenderas inte ZETIA till dessa patienter. [Ser KLINISK FARMAKOLOGI ]
Information om patientrådgivning
Ser FDA-godkänd patientmärkning (PATIENTINFORMATION).
Patienter bör rådas att följa deras nationella kolesterolutbildningsprogram (NCEP) - rekommenderad diet, ett regelbundet träningsprogram och regelbundna tester av en fastande lipidpanel.
Träningsvärk
Alla patienter som påbörjar behandling med ezetimib bör informeras om risken för myopati och uppmanas att omedelbart rapportera oförklarlig muskelsmärta, ömhet eller svaghet. Risken att detta inträffar ökar när man tar vissa typer av medicin. Patienter bör diskutera all medicinering, både receptbelagd och receptfria, med sin läkare.
Leverenzymer
Levertester ska utföras när ZETIA 10 mg läggs till statinbehandling och enligt statinrekommendationer.
Graviditet
Kvinnor i fertil ålder bör rådas att använda en effektiv preventivmetod för att förhindra graviditet medan de använder ZETIA som tillägg till statinbehandling. Diskutera framtida graviditetsplaner med dina patienter och diskutera när de ska avbryta kombinationen ZETIA 10 mg och statinbehandling om de försöker bli gravida. Patienter bör informeras om att om de blir gravida ska de sluta ta kombinationen ZETIA 10 mg och statinbehandling och ringa sin läkare.
Amning
Kvinnor som ammar bör rådas att inte använda ZETIA som tillägg till statinbehandling. Patienter som har en lipidrubbning och ammar bör rådas att diskutera alternativen med sin vårdpersonal.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
En 104-veckors dietkarcinogenicitetsstudie med ezetimib utfördes på råttor i doser upp till 1500 mg/kg/dag (hanar) och 500 mg/kg/dag (honor) (~20 x den mänskliga exponeringen vid 10 mg dagligen baserat på AUC0 -24 timmar för total ezetimib). En 104-veckors dietkarcinogenicitetsstudie med ezetimib utfördes också på möss vid doser upp till 500 mg/kg/dag (> 150 gånger den mänskliga exponeringen vid 10 mg dagligen baserat på AUC0-24 timmar för total ezetimib). Det fanns inga statistiskt signifikanta ökningar av tumörincidensen hos läkemedelsbehandlade råttor eller möss.
Inga tecken på mutagenicitet observerades in vitro i ett mikrobiellt mutagenicitetstest (Ames) med Salmonella typhimurium och Escherichia coli med eller utan metabolisk aktivering. Inga tecken på klastogenicitet observerades in vitro i en kromosomavvikelseanalys i humana perifera blodlymfocyter med eller utan metabolisk aktivering. Dessutom fanns det inga tecken på genotoxicitet i in vivo-musmikronkärntestet.
orala (gavage) fertilitetsstudier av ezetimib utförda på råttor, fanns det inga tecken på reproduktionstoxicitet vid doser upp till 1000 mg/kg/dag på han- eller honråttor (~7 x den mänskliga exponeringen vid 10 mg dagligen baserat på AUC0- 24 timmar för total ezetimib).
Användning i specifika populationer
Graviditet
Graviditetskategori C
Det finns inga adekvata och välkontrollerade studier av ezetimib på gravida kvinnor. Ezetimib ska endast användas under graviditet om den potentiella nyttan överväger risken för fostret.
orala (gavage) embryo-fosterutvecklingsstudier av ezetimib utförda på råttor och kaniner under organogenes, fanns inga tecken på embryoletala effekter vid de testade doserna (250, 500, 1000 mg/kg/dag). Hos råttor observerades en ökad förekomst av vanliga fosterskelettfynd (extra par bröstrevben, obruten cervikal vertebral centra, förkortade revben) vid 1000 mg/kg/dag (~10 x den mänskliga exponeringen vid 10 mg dagligen baserat på AUC0-24 timmar för total ezetimib). Hos kaniner som behandlats med ezetimib observerades en ökad incidens av extra bröstrevben vid 1000 mg/kg/dag (150 gånger den mänskliga exponeringen vid 10 mg dagligen baserat på AUC0-24 timmar för total ezetimib). Ezetimib korsade placentan när gravida råttor och kaniner fick flera orala doser.
Flerdosstudier av ezetimib i kombination med statiner på råttor och kaniner under organogenes resulterar i högre exponeringar för ezetimib och statiner. Reproduktionsfynd förekommer vid lägre doser i kombinationsterapi jämfört med monoterapi.
Alla statiner är kontraindicerade hos gravida och ammande kvinnor. När ZETIA 10 mg administreras med en statin till en kvinna i fertil ålder, se graviditetskategorin och produktmärkningen för statinet. [Se KONTRAINDIKATIONER]
Ammande mödrar
Det är inte känt om ezetimib utsöndras i human bröstmjölk. I råttstudier var exponeringen för total ezetimib hos ammande ungar upp till hälften av den som observerades i moderns plasma. Eftersom många läkemedel utsöndras i bröstmjölk bör försiktighet iakttas när ZETIA 10 mg ges till en ammande kvinna. ZETIA ska inte användas till ammande mödrar såvida inte den potentiella nyttan motiverar den potentiella risken för barnet.
Pediatrisk användning
Effekterna av ZETIA tillsammans med simvastatin (n=126) jämfört med simvastatinmonoterapi (n=122) har utvärderats hos tonåringar hos pojkar och flickor med heterozygot familjär hyperkolesterolemi (HeFH). I en multicenter, dubbelblind, kontrollerad studie följt av en öppen fas, 142 pojkar och 106 postmenarkala flickor, 10 till 17 år (medelålder 14,2 år, 43 % kvinnor, 82 % kaukasier, 4 % asiater, 2 % svarta , 13 % multi-racial) med HeFH randomiserades för att få antingen ZETIA 10 mg samtidigt administrerat med simvastatin eller simvastatin monoterapi. Inkludering i studien krävde 1) en baslinjenivå av LDL-C mellan 160 och 400 mg/dL och 2) en medicinsk historia och klinisk presentation i överensstämmelse med HeFH. Det genomsnittliga LDL-C-värdet vid baslinjen var 225 mg/dL (intervall: 161-351 mg/dL) i ZETIA 10 mg tillsammans med simvastatingruppen jämfört med 219 mg/dL (intervall: 149-336 mg/dL) i monoterapin med simvastatin grupp. Patienterna fick samtidigt ZETIA och simvastatin (10 mg, 20 mg eller 40 mg) eller simvastatin monoterapi (10 mg, 20 mg eller 40 mg) i 6 veckor, samtidigt administrerade ZETIA och 40 mg simvastatin eller 40 mg simvastatin monoterapi för de följande 27 veckorna, och öppen samtidig administrering av ZETIA och simvastatin (10 mg, 20 mg eller 40 mg) i 20 veckor därefter.
Resultaten av studien vid vecka 6 sammanfattas i tabell 3. Resultaten vid vecka 33 överensstämde med dem vid vecka 6.
TABELL 3: Genomsnittlig procentskillnad vid vecka 6 mellan den poolade ZETIA 10 mg tillsammans med simvastatingruppen och den poolade simvastatinmonoterapigruppen hos ungdomar med heterozygot familjär hyperkolesterolemi
Från början av prövningen till slutet av vecka 33 inträffade avbrott på grund av en biverkning hos 7 (6 %) patienter i ZETIA som administrerades samtidigt med simvastatingruppen och hos 2 (2 %) patienter i monoterapigruppen med simvastatin.
Under studien inträffade förhöjda levertransaminaser (två på varandra följande mätningar för ALAT och/eller ASAT ≥3 x ULN) hos fyra (3 %) individer i ZETIA 10 mg som administrerades samtidigt med simvastatingruppen och hos två (2 %) individer i monoterapin med simvastatin grupp. Förhöjningar av CPK (≥10 x ULN) förekom hos två (2 %) individer i ZETIA-gruppen som administrerades samtidigt med simvastatingruppen och hos noll individer i monoterapigruppen med simvastatin.
I denna begränsade kontrollerade studie fanns det ingen signifikant effekt på tillväxt eller sexuell mognad hos ungdomar hos pojkar eller flickor, eller på menstruationscykelns längd hos flickor.
Samtidig administrering av ZETIA 10 mg och simvastatin i doser högre än 40 mg/dag har inte studerats hos ungdomar. ZETIA 10 mg har inte heller studerats hos patienter yngre än 10 år eller hos premenarkala flickor.
Baserat på totalt ezetimib (ezetimib + ezetimib-glukuronid) finns det inga farmakokinetiska skillnader mellan ungdomar och vuxna. Farmakokinetiska data för den pediatriska populationen
Geriatrisk användning
Monoterapistudier
Av de 2396 patienter som fick ZETIA 10 mg i kliniska studier var 669 (28%) 65 år och äldre och 111 (5%) var 75 år och äldre.
Studier av samtidig administrering av statiner
Av de 11 308 patienter som fick ZETIA + statin i kliniska studier var 3587 (32%) 65 år och äldre och 924 (8%) var 75 år och äldre.
Inga övergripande skillnader i säkerhet och effektivitet observerades mellan dessa patienter och yngre patienter, och annan rapporterad klinisk erfarenhet har inte identifierat skillnader i svar mellan äldre och yngre patienter, men större känslighet hos vissa äldre individer kan inte uteslutas [se KLINISK FARMAKOLOGI ].
Nedsatt njurfunktion
När det används som monoterapi är ingen dosjustering av ZETIA 10 mg nödvändig.
studien av hjärt- och njurskyddsstudien (SHARP) med 9270 patienter med måttligt till gravt nedsatt njurfunktion (6247 icke-dialyspatienter med median serumkreatinin 2,5 mg/dL och median uppskattad glomerulär filtrationshastighet 25,6 ml/min/1,73 m², och 3023 dialyspatienter), incidensen av allvarliga biverkningar, biverkningar som ledde till att studiebehandlingen avbröts eller biverkningar av särskilt intresse (muskuloskeletala biverkningar, leverenzymavvikelser, incident cancer) var liknande för patienter som någonsin tilldelats ezetimib 10 mg plus simvastatin 20 mg (n=4650) eller placebo (n=4620) under en medianuppföljning på 4,9 år. Men eftersom nedsatt njurfunktion är en riskfaktor för statinassocierad myopati, bör doser av simvastatin som överstiger 20 mg användas med försiktighet och noggrann övervakning när de administreras samtidigt med ZETIA till patienter med måttligt till gravt nedsatt njurfunktion.
Nedsatt leverfunktion
ZETIA rekommenderas inte till patienter med måttligt till gravt nedsatt leverfunktion [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och KLINISK FARMAKOLOGI ].
ZETIA 10 mg givet samtidigt med ett statin är kontraindicerat hos patienter med aktiv leversjukdom eller oförklarade ihållande förhöjningar av levertransaminasnivåer [se KONTRAINDIKATIONER ; VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och KLINISK FARMAKOLOGI ].
ÖVERDOS
I kliniska studier, administrering av ezetimib, 50 mg/dag till 15 friska försökspersoner i upp till 14 dagar, 40 mg/dag till 18 patienter med primär hyperlipidemi i upp till 56 dagar och 40 mg/dag till 27 patienter med homozygot sitosterolemi för 26 veckor tolererades i allmänhet väl. En kvinnlig patient med homozygot sitosterolemi tog en oavsiktlig överdos av ezetimib 120 mg/dag under 28 dagar utan rapporterade kliniska eller laboratoriemässiga biverkningar.
I händelse av en överdos ska symtomatiska och stödjande åtgärder vidtas.
KONTRAINDIKATIONER
ZETIA är kontraindicerat under följande tillstånd:
- Kombinationen av ZETIA 10 mg med en statin är kontraindicerad hos patienter med aktiv leversjukdom eller oförklarade ihållande förhöjningar av levertransaminasnivåer.
- Kvinnor som är gravida eller kan bli gravida. Eftersom statiner minskar kolesterolsyntesen och möjligen syntesen av andra biologiskt aktiva substanser som härrör från kolesterol, kan ZETIA i kombination med en statin orsaka fosterskada när det ges till gravida kvinnor. Dessutom finns det ingen uppenbar fördel med behandling under graviditet, och säkerheten hos gravida kvinnor har inte fastställts. Om patienten blir gravid under behandlingen med detta läkemedel, bör patienten informeras om den potentiella faran för fostret och avsaknaden av känd klinisk nytta med fortsatt användning under graviditet. [Ser Användning i specifika populationer ]
- Ammande mödrar. Eftersom statiner kan passera över i bröstmjölk och eftersom statiner har potential att orsaka allvarliga biverkningar hos ammande spädbarn, bör kvinnor som behöver ZETIA-behandling i kombination med statin rådas att inte amma sina spädbarn [se Användning i specifika populationer ].
- Patienter med känd överkänslighet mot någon komponent i denna produkt. Överkänslighetsreaktioner inklusive anafylaxi, angioödem, hudutslag och urtikaria har rapporterats med ZETIA [se NEGATIVA REAKTIONER ].
KLINISK FARMAKOLOGI
Handlingsmekanism
Ezetimib sänker kolesterolet i blodet genom att hämma absorptionen av kolesterol i tunntarmen. I en 2-veckors klinisk studie på 18 hyperkolesterolemiska patienter hämmade ZETIA 10 mg kolesterolabsorptionen i tarmen med 54 % jämfört med placebo. ZETIA hade ingen kliniskt betydelsefull effekt på plasmakoncentrationerna av de fettlösliga vitaminerna A, D och E (i en studie med 113 patienter) och försämrade inte produktionen av binjurebarksteroidhormon (i en studie med 118 patienter).
Kolesterolhalten i levern kommer huvudsakligen från tre källor. Levern kan syntetisera kolesterol, ta upp kolesterol från blodet från cirkulerande lipoproteiner eller ta upp kolesterol som absorberas av tunntarmen. Intestinalt kolesterol härrör främst från kolesterol som utsöndras i gallan och från kolesterol i kosten.
Ezetimib har en verkningsmekanism som skiljer sig från den hos andra klasser av kolesterolsänkande föreningar (statiner, gallsyrabindare [hartser], fibrinsyraderivat och växtstanoler). Det molekylära målet för ezetimib har visat sig vara steroltransportören, Niemann-Pick C1-Like 1 (NPC1L1), som är involverad i tarmens upptag av kolesterol och fytosteroler.
Ezetimib hämmar inte kolesterolsyntesen i levern eller ökar gallsyrautsöndringen. Istället lokaliseras ezetimib vid borstkanten av tunntarmen och hämmar absorptionen av kolesterol, vilket leder till en minskning av leveransen av intestinalt kolesterol till levern. Detta orsakar en minskning av leverkolesteroldepåer och en ökning av clearance av kolesterol från blodet; denna distinkta mekanism är komplementär till den för statiner och fenofibrat [se Kliniska studier ].
Farmakodynamik
Kliniska studier har visat att förhöjda nivåer av total-C, LDL-C och Apo B, den huvudsakliga proteinbeståndsdelen i LDL, främjar human ateroskleros. Dessutom är minskade nivåer av HDL-C associerade med utvecklingen av ateroskleros. Epidemiologiska studier har fastställt att kardiovaskulär morbiditet och mortalitet varierar direkt med nivån av total-C och LDL-C och omvänt med nivån av HDL-C. Liksom LDL kan kolesterolberikade triglyceridrika lipoproteiner, inklusive lipoproteiner med mycket låg densitet (VLDL), lipoproteiner med medeldensitet (IDL) och rester, också främja åderförkalkning. Den oberoende effekten av att höja HDL-C eller sänka TG på risken för koronar och kardiovaskulär sjuklighet och mortalitet har inte fastställts.
ZETIA minskar total-C, LDL-C, Apo B, icke-HDL-C och TG, och ökar HDL-C hos patienter med hyperlipidemi. Administrering av ZETIA 10 mg med en statin är effektiv för att förbättra serum total-C, LDL-C, Apo B, icke-HDL-C, TG och HDL-C utöver endera behandlingen. Administrering av ZETIA 10 mg med fenofibrat är effektivt för att förbättra serum totalt-C, LDL-C, Apo B och icke-HDL-C hos patienter med blandad hyperlipidemi jämfört med endera behandlingen. Effekterna av ezetimib givet antingen ensamt eller som tillägg till ett statin eller fenofibrat på kardiovaskulär morbiditet och mortalitet har inte fastställts.
Farmakokinetik
Absorption
Efter oral administrering absorberas ezetimib och konjugeras i stor utsträckning till en farmakologiskt aktiv fenolisk glukuronid (ezetimib-glukuronid). Efter en engångsdos på 10 mg ZETIA 10 mg till fastande vuxna uppnåddes genomsnittliga maximala plasmakoncentrationer av ezetimib (Cmax) på 3,4 till 5,5 ng/ml inom 4 till 12 timmar (Tmax ). Genomsnittliga Cmax-värden för ezetimib-glukuronid på 45 till 71 ng/ml uppnåddes mellan 1 och 2 timmar (Tmax). Det fanns ingen väsentlig avvikelse från dosproportionaliteten mellan 5 och 20 mg. Den absoluta biotillgängligheten av ezetimib kan inte fastställas, eftersom föreningen är praktiskt taget olöslig i vattenhaltiga medier lämpliga för injektion.
Effekt Av Mat På Oral Absorption
Samtidig födointag (fettrika eller fettfria måltider) hade ingen effekt på graden av absorption av ezetimib när det administrerades som ZETIA 10 mg tabletter. C-värdet för ezetimib ökade med 38 % vid intag av måltider med hög fetthalt. ZETIA kan administreras med eller utan mat.
Distribution
Ezetimib och ezetimib-glukuronid är starkt bundna (> 90%) till humana plasmaproteiner.
Metabolism och utsöndring
Ezetimib metaboliseras primärt i tunntarmen och levern via glukuronidkonjugering (en fas II-reaktion) med efterföljande gall- och renal utsöndring. Minimal oxidativ metabolism (en fas I-reaktion) har observerats hos alla utvärderade arter.
Hos människor metaboliseras ezetimib snabbt till ezetimib-glukuronid. Ezetimib och ezetimibeglukuronid är de huvudsakliga läkemedelshärledda föreningarna som detekteras i plasma, och de utgör cirka 10 till 20 % respektive 80 till 90 % av det totala läkemedlet i plasma. Både ezetimib och ezetimib-glukuronid elimineras från plasma med en halveringstid på cirka 22 timmar för både ezetimib och ezetimibeglukuronid. Plasmakoncentration-tidsprofiler uppvisar flera toppar, vilket tyder på enterohepatisk återvinning.
Efter oral administrering av 14C-ezetimib (20 mg) till människor stod total ezetimib (ezetimib + ezetimib-glukuronid) för cirka 93 % av den totala radioaktiviteten i plasma. Efter 48 timmar fanns inga detekterbara nivåer av radioaktivitet i plasman.
Ungefär 78 % och 11 % av den administrerade radioaktiviteten återfanns i avföringen respektive urinen under en 10-dagars uppsamlingsperiod. Ezetimib var huvudkomponenten i avföring och stod för 69 % av den administrerade dosen, medan ezetimib-glukuronid var huvudkomponenten i urinen och stod för 9 % av den administrerade dosen.
Specifika populationer
Geriatriska patienter: I en flerdosstudie med ezetimib givet 10 mg en gång dagligen i 10 dagar, var plasmakoncentrationerna för totalt ezetimib cirka 2 gånger högre hos äldre (≥65 år) friska försökspersoner jämfört med yngre försökspersoner.
Pediatriska patienter: [Ser Användning i specifika populationer ]
Kön: en flerdosstudie med ezetimib givet 10 mg en gång dagligen i 10 dagar var plasmakoncentrationerna för totalt ezetimib något högre (
Lopp: Baserat på en metaanalys av farmakokinetiska studier med flera doser, fanns inga farmakokinetiska skillnader mellan svarta och kaukasiska försökspersoner. Studier på asiatiska försökspersoner visade att farmakokinetiken för ezetimib liknade den som ses hos kaukasiska försökspersoner.
Nedsatt leverfunktion: Efter en engångsdos på 10 mg ezetimib ökade medel-AUC för totalt ezetimib cirka 1,7 gånger hos patienter med lätt nedsatt leverfunktion (Child-Pugh-poäng 5 till 6), jämfört med friska försökspersoner. De genomsnittliga AUC-värdena för total ezetimib och ezetimib ökade cirka 3 till 4 gånger respektive 5 till 6 gånger hos patienter med måttlig (Child-Pugh poäng 7 till 9) eller gravt nedsatt leverfunktion (Child-Pugh poäng 10 till 15). I en 14-dagars studie med flera doser (10 mg dagligen) på patienter med måttligt nedsatt leverfunktion ökade de genomsnittliga AUC-värdena för total ezetimib och ezetimib cirka 4 gånger på dag 1 och dag 14 jämfört med friska försökspersoner. På grund av de okända effekterna av den ökade exponeringen för ezetimib hos patienter med måttligt eller gravt nedsatt leverfunktion, rekommenderas inte ZETIA till dessa patienter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Nedsatt njurfunktion: Efter en engångsdos på 10 mg ezetimib till patienter med allvarlig njursjukdom (n=8; medel-CrCl ≥ 30 ml/min/1,73 m²) ökade de genomsnittliga AUC-värdena för total ezetimib, ezetimib-glukuronid och ezetimib med cirka 1,5 -faldigt jämfört med friska försökspersoner (n=9).
Läkemedelsinteraktioner
[Se även LÄKEMEDELSINTERAKTIONER ]
ZETIA 10 mg hade ingen signifikant effekt på en serie probläkemedel (koffein, dextrometorfan, tolbutamid och IV midazolam) som är kända för att metaboliseras av cytokrom P450 (1A2, 2D6, 2C8/9 och 3A4) i en "cocktail"-studie av tolv friska vuxna män. Detta tyder på att ezetimib varken är en hämmare eller en inducerare av dessa cytokrom P450-isozymer, och det är osannolikt att ezetimib kommer att påverka metabolismen av läkemedel som metaboliseras av dessa enzymer.
TABELL 4: Effekt av samtidigt administrerade läkemedel på totalt ezetimib
TABELL 5: Effekt av samtidig administrering av ezetimib på systemisk exponering för andra läkemedel
Djurtoxikologi och/eller farmakologi
Den hypokolesterolemiska effekten av ezetimib utvärderades i kolesterolmatade Rhesus-apor, hundar, råttor och musmodeller av human kolesterolmetabolism. Ezetimib visade sig ha ett ED50-värde på 0,5 μg/kg/dag för att hämma ökningen av plasmakolesterolnivåer hos apor. ED50-värdena hos hundar, råttor och möss var 7, 30 respektive 700 μg/kg/dag. Dessa resultat överensstämmer med att ZETIA är en potent kolesterolabsorptionshämmare.
I en råttmodell, där glukuronidmetaboliten av ezetimib (SCH 60663) administrerades intraduodenalt, var metaboliten lika potent som moderföreningen (SCH 58235) när det gällde att hämma absorptionen av kolesterol, vilket tyder på att glukuronidmetaboliten hade liknande aktivitet som föräldern. läkemedel.
1-månadersstudier på hundar som fick ezetimib (0,03 till 300 mg/kg/dag), ökade koncentrationen av kolesterol i gallblåsans galla ~2- till 4-faldigt. En dos på 300 mg/kg/dag administrerad till hundar under ett år resulterade dock inte i gallstensbildning eller några andra skadliga effekter på lever och gallvägar. I en 14-dagars studie på möss som fick ezetimib (0,3 till 5 mg/kg/dag) och som fick en diet med låg fetthalt eller kolesterolrik, var koncentrationen av kolesterol i gallblåsans galla antingen opåverkad eller reducerad till normala nivåer.
En serie akuta prekliniska studier utfördes för att fastställa ZETIAs selektivitet för att hämma kolesterolabsorptionen. Ezetimib hämmade absorptionen av 14C-kolesterol utan effekt på absorptionen av triglycerider, fettsyror, gallsyror, progesteron, etinylestradiol eller de fettlösliga vitaminerna A och D.
toxicitetsstudier på 4 till 12 veckor på möss inducerade inte ezetimib cytokrom P450 läkemedelsmetaboliserande enzymer. I toxicitetsstudier sågs en farmakokinetisk interaktion mellan ezetimib och statiner (föräldrar eller deras aktiva hydroxisyrametaboliter) hos råttor, hundar och kaniner.
Kliniska studier
Primär hyperlipidemi
ZETIA 10 mg minskar total-C, LDL-C, Apo B, icke-HDL-C och TG, och ökar HDL-C hos patienter med hyperlipidemi. Maximalt till nästan maximalt svar uppnås vanligtvis inom 2 veckor och bibehålls under kronisk behandling.
Monoterapi
I två multicenter, dubbelblinda, placebokontrollerade, 12-veckorsstudier på 1719 patienter med primär hyperlipidemi, sänkte ZETIA signifikant total-C, LDL-C, Apo B, icke-HDL-C och TG, och ökade HDL- C jämfört med placebo (se tabell 6). Minskningen av LDL-C var konsekvent över ålder, kön och baseline LDL-C.
TABELL 6: Svar på ZETIA 10 mg hos patienter med primär hyperlipidemi (medelvärde för % förändring från obehandlad baslinje†)
Kombination med statiner
ZETIA 10mg tillsatt till pågående statinterapi
I en multicenter, dubbelblind, placebokontrollerad, 8 veckor lång studie visade 769 patienter med primär hyperlipidemi, känd kranskärlssjukdom eller flera kardiovaskulära riskfaktorer som redan fick statinmonoterapi, men som inte hade uppnått sitt NCEP ATP II-mål LDL -C-målet randomiserades till att få antingen ZETIA 10 mg eller placebo utöver sitt pågående statin.
ZETIA 10 mg, tillsatt till pågående statinbehandling, sänkte signifikant total-C, LDL-C, Apo B, icke-HDL-C och TG och ökade HDL-C jämfört med en statin administrerad ensam (se tabell 7). LDL-C-reduktioner inducerade av ZETIA 10 mg var generellt konsekventa för alla statiner.
TABELL 7: Svar på tillägg av ZETIA 10 mg till pågående statinterapi hos patienter med hyperlipidemi (medelvärde för % förändring från behandlad baslinje‡)
ZETIA Initieras samtidigt med en statin
fyra multicenter, dubbelblinda, placebokontrollerade, 12-veckorsstudier, hos 2382 hyperlipidemiska patienter, administrerades ZETIA eller placebo ensamt eller med olika doser av atorvastatin, simvastatin, pravastatin eller lovastatin.
När alla patienter som fick ZETIA med en statin jämfördes med alla som enbart fick motsvarande statin, sänkte ZETIA 10 mg signifikant total-C, LDL-C, Apo B, icke-HDL-C och TG, och med undantag för pravastatin , ökade HDL-C jämfört med statinet administrerat ensamt. LDL-C-reduktioner inducerade av ZETIA 10 mg var generellt konsekventa för alla statiner. (Se fotnot, tabellerna 8 till 11.)
TABELL 8: Svar på ZETIA 10 mg och atorvastatin initierat samtidigt hos patienter med primär hyperlipidemi (medelvärde för % förändring från obehandlad baslinje†)
TABELL 9: Svar på ZETIA 10 mg och simvastatin initierat samtidigt hos patienter med primär hyperlipidemi (medelvärde för % förändring från obehandlad baslinje†)
TABELL 10: Svar på ZETIA och Pravastatin initierat samtidigt hos patienter med primär hyperlipidemi (medelvärde för % förändring från obehandlad baslinje†)
TABELL 11: Svar på ZETIA och Lovastatin initierat samtidigt hos patienter med primär hyperlipidemi (medelvärde för % förändring från obehandlad baslinje†)
Kombination med fenofibrat
I en multicenter, dubbelblind, placebokontrollerad, klinisk studie på patienter med blandad hyperlipidemi, behandlades 625 patienter i upp till 12 veckor och 576 i upp till ytterligare 48 veckor. Patienterna randomiserades till att få placebo, enbart ZETIA, enbart 160 mg fenofibrat eller ZETIA 10 mg och 160 mg fenofibrat i den 12 veckor långa studien. Efter att ha avslutat den 12 veckor långa studien tilldelades kvalificerade patienter ZETIA samtidigt som fenofibrat eller fenofibrat monoterapi under ytterligare 48 veckor.
ZETIA 10 mg samtidigt administrerat med fenofibrat sänkte signifikant total-C, LDL-C, Apo B och icke-HDL-C jämfört med fenofibrat administrerat ensamt. Den procentuella minskningen av TG och den procentuella ökningen av HDLC för ZETIA samtidigt administrerat med fenofibrat var jämförbara med de för fenofibrat administrerat ensamt (se tabell 12).
TABELL 12: Svar på ZETIA 10 mg och fenofibrat initierat samtidigt hos patienter med blandad hyperlipidemi (medelvärde för % förändring från obehandlad baslinje† vid 12 veckor†)
Förändringarna i lipid-endpoints efter ytterligare 48 veckors behandling med ZETIA samtidigt administrerat med fenofibrat eller med enbart fenofibrat överensstämde med de 12-veckorsdata som visas ovan.
Homozygot familjär hyperkolesterolemi (HoFH)
En studie genomfördes för att utvärdera effektiviteten av ZETIA vid behandling av HoFH. Denna dubbelblinda, randomiserade, 12-veckorsstudie inkluderade 50 patienter med en klinisk och/eller genotypisk diagnos av HoFH, med eller utan samtidig LDL-aferes, som redan fick atorvastatin eller simvastatin (40 mg). Patienterna randomiserades till en av tre behandlingsgrupper, atorvastatin eller simvastatin (80 mg), ZETIA 10 mg administrerat med atorvastatin eller simvastatin (40 mg), eller ZETIA administrerat med atorvastatin eller simvastatin (80 mg). På grund av minskad biotillgänglighet av ezetimib hos patienter som samtidigt får kolestyramin [se LÄKEMEDELSINTERAKTIONER ezetimib doserades minst 4 timmar före eller efter administrering av hartser. Genomsnittlig baslinje för LDL-C var 341 mg/dL hos de patienter som randomiserades till atorvastatin 80 mg eller simvastatin 80 mg enbart och 316 mg/dL i gruppen som randomiserades till ZETIA 10 mg plus atorvastatin 40 eller 80 mg eller simvastatin 40 eller 80 mg. ZETIA 10 mg, administrerat med atorvastatin eller simvastatin (40- och 80-mg statingrupper, poolade), minskade signifikant LDL-C (21%) jämfört med att öka dosen av simvastatin eller atorvastatin monoterapi från 40 till 80 mg (7%). Hos dem som behandlades med ZETIA 10 mg plus 80 mg atorvastatin eller med ZETIA 10 mg plus 80 mg simvastatin, minskade LDL-C med 27 %.
Homozygot sitosterolemi (fytosterolemi)
En studie genomfördes för att utvärdera effektiviteten av ZETIA vid behandling av homozygot sitosterolemi. I denna multicenter, dubbelblinda, placebokontrollerade, 8-veckors studie, 37 patienter med homozygot sitosterolemi med förhöjda plasma sitosterolnivåer (> 5 mg/dL) på sin nuvarande terapeutiska regim (diet, gallsyrabindande hartser, statiner, ileal bypass-operation och/eller LDL-aferes), randomiserades till ZETIA (n=30) eller placebo (n=7). På grund av minskad biotillgänglighet av ezetimib hos patienter som samtidigt får kolestyramin [se LÄKEMEDELSINTERAKTIONER ezetimib doserades minst 2 timmar före eller 4 timmar efter att hartser administrerades. Exklusive den ena patienten som fick LDL-aferes, sänkte ZETIA signifikant plasmasitosterol och kampesterol med 21 % respektive 24 % från baslinjen. Däremot hade patienter som fick placebo ökningar av sitosterol och kampesterol på 4 % respektive 3 % från baslinjen. För patienter som behandlats med ZETIA 10 mg minskade medelplasmanivåerna av växtsteroler progressivt under studiens gång. Effekterna av att minska plasmasitosterol och kampesterol på att minska riskerna för kardiovaskulär sjuklighet och mortalitet har inte fastställts.
Minskningar av sitosterol och kampesterol var konsekventa mellan patienter som tog ZETIA 10 mg samtidigt med gallsyrabindare (n=8) och patienter som inte fick samtidig behandling med gallsyrabindare (n=21).
Användningsbegränsningar
Effekten av ZETIA 10 mg på kardiovaskulär morbiditet och mortalitet har inte fastställts.
PATIENTINFORMATION
ZETIA® (ezetimib) Tabletter
Patientinformation om ZETIA (zet´-ea)
Generiskt namn: ezetimibe (e-zet´-e-mib)
Läs denna information noggrant innan du börjar ta ZETIA® och varje gång du får i dig mer ZETIA. Det kan komma ny information. Denna information ersätter inte att prata med din läkare om ditt medicinska tillstånd eller din behandling. Om du har några frågor om ZETIA, fråga din läkare. Endast din läkare kan avgöra om ZETIA är rätt för dig.
Vad är ZETIA?
ZETIA är ett läkemedel som används för att sänka nivåerna av totalkolesterol och LDL (dåligt) kolesterol i blodet. ZETIA är för patienter som inte kan kontrollera sina kolesterolvärden enbart med diet och träning. Det kan användas ensamt eller tillsammans med andra läkemedel för att behandla högt kolesterol. Du bör hålla dig på en kolesterolsänkande diet medan du tar detta läkemedel.
ZETIA arbetar för att minska mängden kolesterol som din kropp absorberar. ZETIA 10mg hjälper dig inte gå ner i vikt. ZETIA 10 mg har inte visats förebygga hjärtsjukdomar eller hjärtinfarkter.
För mer information om kolesterol, se "Vad ska jag veta om högt kolesterol?" avsnitt som följer.
Vem bör inte ta ZETIA 10mg?
- Ta inte ZETIA 10 mg om du är allergisk mot ezetimib, den aktiva ingrediensen i ZETIA, eller mot de inaktiva ingredienserna. För en lista över inaktiva ingredienser, se avsnittet "Inaktiva ingredienser" som följer.
- Om du har aktiv leversjukdom, ta inte ZETIA 10 mg medan du tar kolesterolsänkande läkemedel som kallas statiner.
- Om du är gravid eller ammar, ta inte ZETIA medan du tar ett statin.
- Om du är en kvinna i fertil ålder bör du använda en effektiv preventivmetod för att förhindra graviditet medan du använder ZETIA som tillägg till statinbehandling.
ZETIA har inte studerats på barn under 10 år.
Vad ska jag berätta för min läkare innan och medan jag tar ZETIA 10mg?
Berätta för din läkare om alla receptbelagda och receptfria läkemedel du tar eller planerar att ta, inklusive naturläkemedel eller naturläkemedel.
Berätta för din läkare om alla dina medicinska tillstånd inklusive allergier.
Tala om för din läkare om du:
- någonsin haft leverproblem. ZETIA 10mg kanske inte är rätt för dig.
- är gravid eller planerar att bli gravid. Din läkare kommer att diskutera med dig om ZETIA 10 mg är rätt för dig.
- ammar. Vi vet inte om ZETIA 10 mg kan passera till ditt barn genom din mjölk. Din läkare kommer att diskutera med dig om ZETIA 10 mg är rätt för dig.
- uppleva oförklarlig muskelsmärta, ömhet eller svaghet.
Hur ska jag ta ZETIA 10mg?
- Ta ZETIA en gång om dagen, med eller utan mat. Det kan vara lättare att komma ihåg att ta din dos om du gör den vid samma tidpunkt varje dag, till exempel med frukost, middag eller vid sänggåendet. Om du också tar ett annat läkemedel för att sänka ditt kolesterol, fråga din läkare om du kan ta dem samtidigt.
- Om du glömmer att ta ZETIA, ta det så snart du kommer ihåg det. Ta dock inte mer än en dos ZETIA om dagen.
- Fortsätt att följa en kolesterolsänkande diet medan du tar ZETIA. Fråga din läkare om du behöver kostinformation.
- Fortsätt att ta ZETIA 10 mg om inte din läkare säger åt dig att sluta. Det är viktigt att du fortsätter att ta ZETIA 10 mg även om du inte känner dig illamående.
- Se din läkare regelbundet för att kontrollera din kolesterolnivå och för att kontrollera biverkningar. Din läkare kan ta blodprover för att kontrollera din lever innan du börjar ta ZETIA med en statin och under behandlingen.
Vilka är de möjliga biverkningarna av ZETIA?
kliniska studier rapporterade patienter få biverkningar när de tog ZETIA. Dessa inkluderade diarré, ledvärk och trötthetskänsla.
Patienter har upplevt allvarliga muskelproblem när de tagit ZETIA 10 mg, vanligtvis när ZETIA 10 mg lagts till ett statinläkemedel. Om du upplever oförklarlig muskelsmärta, ömhet eller svaghet när du tar ZETIA, kontakta din läkare omedelbart. Du måste göra detta omedelbart, för i sällsynta fall kan dessa muskelproblem vara allvarliga, med muskelnedbrytning som resulterar i njurskador.
Dessutom har följande biverkningar rapporterats vid allmän användning: allergiska reaktioner (som kan kräva behandling omedelbart) inklusive svullnad av ansikte, läppar, tunga och/eller svalg som kan orsaka svårigheter att andas eller svälja, utslag och nässelfeber. ; upphöjda röda utslag, ibland med målformade lesioner; ledvärk; muskelvärk; förändringar i vissa laboratorieblodprov; leverproblem; magont; inflammation i bukspottkörteln; illamående; yrsel; kittlande känsla; depression; huvudvärk; gallstenar; inflammation i gallblåsan.
Tala om för din läkare om du har dessa eller andra medicinska problem medan du tar ZETIA. För en fullständig lista över biverkningar, fråga din läkare eller apotekspersonal.
Vad ska jag veta om högt kolesterol?
Kolesterol är en typ av fett som finns i ditt blod. Ditt totala kolesterol består av LDL- och HDL-kolesterol.
LDL-kolesterol kallas "dåligt" kolesterol eftersom det kan byggas upp i väggarna i dina artärer och bilda plack. Med tiden kan plackuppbyggnad orsaka en förträngning av artärerna. Denna förträngning kan bromsa eller blockera blodflödet till ditt hjärta, hjärna och andra organ. Högt LDL-kolesterol är en viktig orsak till hjärtsjukdomar och en av orsakerna till stroke.
HDL-kolesterol kallas "bra" kolesterol eftersom det hindrar det onda kolesterolet från att byggas upp i artärerna.
Triglycerider är också fetter som finns i ditt blod.
Allmän information om ZETIA
Läkemedel skrivs ibland ut för tillstånd som inte nämns i patientinformationsblad. Använd inte ZETIA 10 mg för ett tillstånd som det inte ordinerats för. Ge inte ZETIA till andra personer, även om de har samma tillstånd som du har. Det kan skada dem.
Detta sammanfattar den viktigaste informationen om ZETIA. Om du vill ha mer information, prata med din läkare. Du kan fråga din apotekspersonal eller läkare om information om ZETIA 10mg som är skriven för vårdpersonal.
Inaktiva Ingredienser :
Kroskarmellosnatrium, laktosmonohydrat, magnesiumstearat, mikrokristallin cellulosa, povidon och natriumlaurylsulfat.
