Tricor 160mg, 200mg Fenofibrate Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Tricor och hur används det?
Tricor är ett receptbelagt läkemedel som används för att behandla minskade symtom på kolesterol och triglycerider (fettsyror) i blodet. Tricor kan användas ensamt eller tillsammans med andra läkemedel.
- Tricor tillhör en klass av läkemedel som kallas fibric Acid Agents.
- Det är inte känt om Tricor 200mg är säkert och effektivt för barn
Vilka är de möjliga biverkningarna av Tricor?
Tricor 200mg kan orsaka allvarliga biverkningar inklusive:
- skarp magsmärta sprider sig till din rygg eller skulderblad,
- aptitlöshet,
- ont i magen efter att bara ha ätit,
- gulfärgning av huden eller ögonen (gulsot),
- feber,
- frossa,
- svaghet,
- öm hals,
- munsår,
- ovanliga blåmärken eller blödningar,
- bröstsmärta,
- plötslig hosta,
- väsande andning,
- snabb andning,
- hosta upp blod, och
- svullnad, värme eller rodnad i en arm eller ett ben
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Tricor inkluderar:
- rinnande näsa,
- nysningar, och
- onormala laboratorietester
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Tricor. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
TRICOR (fenofibrattabletter), är ett lipidreglerande medel tillgängligt som tabletter för oral administrering. Varje tablett innehåller 54 mg eller 160 mg fenofibrat. Det kemiska namnet för fenofibrat är 2-[4-(4-klorbensoyl)fenoxi]-2-metylpropansyra, 1-metyletylester med följande strukturformel:
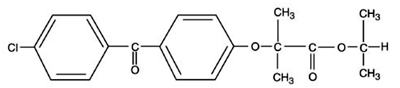
Den empiriska formeln är C20H21O4Cl och molekylvikten är 360,83; fenofibrat är olösligt i vatten. Smältpunkten är 79-82°C. Fenofibrat är ett vitt fast ämne som är stabilt under vanliga förhållanden.
Inaktiva Ingredienser
Varje tablett innehåller kolloidal kiseldioxid, krospovidon, laktosmonohydrat, lecitin, mikrokristallin cellulosa, polyvinylalkohol, povidon, natriumlaurylsulfat, natriumstearylfumarat, talk, titandioxid och xantangummi. Dessutom innehåller 54 mg individuella tabletter D&C Yellow No. 10, FD&C Yellow No. 6, FD&C Blue No. 2.
INDIKATIONER
Primär hyperkolesterolemi eller blandad dyslipidemi
TRICOR är indicerat som tilläggsbehandling till kosten för att minska förhöjt lågdensitetslipoproteinkolesterol (LDL-C), totalkolesterol (Total-C), triglycerider och apolipoprotein B (Apo B), och för att öka högdensitetslipoproteinkolesterol (HDL-) C) hos vuxna patienter med primär hyperkolesterolemi eller blandad dyslipidemi.
Svår hypertriglyceridemi
TRICOR 200mg är också indicerat som tilläggsterapi till diet för behandling av vuxna patienter med svår hypertriglyceridemi. Förbättrad glykemisk kontroll hos diabetespatienter som uppvisar fastande kylomikronemi kommer vanligtvis att undanröja behovet av farmakologisk intervention.
Markant förhöjda nivåer av serumtriglycerider (t.ex. > 2 000 mg/dL) kan öka risken för att utveckla pankreatit. Effekten av fenofibratbehandling på att minska denna risk har inte studerats tillräckligt.
Viktiga användningsbegränsningar
Fenofibrat i en dos motsvarande 145 mg TRICOR visade sig inte minska morbiditet och dödlighet i kranskärlssjukdom i en stor, randomiserad kontrollerad studie av patienter med typ 2-diabetes mellitus [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
DOSERING OCH ADMINISTRERING
allmänna överväganden
Patienter bör placeras på en lämplig lipidsänkande diet innan de får TRICOR 160 mg, och bör fortsätta denna diet under behandling med TRICOR. TRICOR tabletter kan ges utan hänsyn till måltider.
Den initiala behandlingen för dyslipidemi är dietterapi som är specifik för typen av lipoproteinavvikelse. Överdriven kroppsvikt och överdrivet alkoholintag kan vara viktiga faktorer vid hypertriglyceridemi och bör åtgärdas före all läkemedelsbehandling. Fysisk träning kan vara en viktig hjälpåtgärd. Sjukdomar som bidrar till hyperlipidemi, såsom hypotyreos eller diabetes mellitus, bör letas efter och behandlas adekvat. Östrogenbehandling, tiaziddiuretika och betablockerare är ibland förknippade med massiva ökningar av plasmatriglycerider, särskilt hos patienter med familjär hypertriglyceridemi. I sådana fall kan utsättning av det specifika etiologiska medlet undanröja behovet av specifik läkemedelsbehandling av hypertriglyceridemi.
Lipidnivåerna bör övervakas regelbundet och man bör överväga att minska dosen av TRICOR om lipidnivåerna faller väsentligt under målintervallet.
Behandlingen ska avbrytas hos patienter som inte har tillräckligt svar efter två månaders behandling med den maximala rekommenderade dosen på 145 mg en gång dagligen.
Primär hyperkolesterolemi eller blandad dyslipidemi
Initialdosen av TRICOR 200 mg är 145 mg en gång dagligen.
Svår hypertriglyceridemi
Initialdosen är 48 till 145 mg per dag. Doseringen bör anpassas efter patientens svar och bör justeras vid behov efter upprepade lipidbestämningar med 4 till 8 veckors intervall. Den maximala dosen är 145 mg en gång dagligen.
Nedsatt njurfunktion
Behandling med TRICOR 200 mg bör inledas med en dos på 48 mg per dag hos patienter med lätt till måttligt nedsatt njurfunktion och ökas först efter utvärdering av effekterna på njurfunktionen och lipidnivåerna vid denna dos. Användning av TRICOR bör undvikas hos patienter med gravt nedsatt njurfunktion [se Användning i specifika populationer och KLINISK FARMAKOLOGI ].
Geriatriska patienter
Dosval för äldre bör göras på basis av njurfunktionen [se Användning i specifika populationer ].
HUR LEVERERAS
Doseringsformer och styrkor
- 48 mg gula tabletter, märkta med kodidentifieringsbokstäverna "FI".
- 48 mg gula tabletter, präglade med "a"-logotypen och kodidentifieringsbokstäverna "FI".
- 145 mg vita tabletter, präglade med kodidentifieringsbokstäverna "FO".
- 145 mg vita tabletter, präglade med "a"-logotypen och kodidentifieringsbokstäverna "FO".
Förvaring Och Hantering
TRICOR® (fenofibrattabletter) finns i två styrkor:
48 mg
Gula tabletter, präglade med kodidentifieringsbokstäverna "FI", tillgängliga i flaskor om 90 ( NDC 0074-3173-90).
Gula tabletter, präglade med "a"-logotypen och kodidentifieringsbokstäverna "FI", tillgängliga i flaskor om 90 ( NDC 0074-6122-90).
145 mg
Vita tabletter, präglade med kodidentifieringsbokstäverna "FO", tillgängliga i flaskor om 90 ( NDC 0074-3189-90).
Vita tabletter, präglade med "a"-logotypen och kodidentifieringsbokstäver "FO", tillgängliga i flaskor om 90 ( NDC 0074-6123-90).
Lagring
Förvara vid 25°C (77°F); utflykter tillåtna till 15-30°C (59-86°F).
[Se USP-kontrollerad rumstemperatur]. Förvaras oåtkomligt för barn. Skydda mot fukt.
Tillverkad för AbbVie Inc., North Chicago, IL 60064, USA av Fournier Laboratories Ireland Limited, Anngrove, Carrigtwohill Co. Cork, Irland. Reviderad: mars 2021
BIEFFEKTER
Följande allvarliga biverkningar beskrivs nedan och på andra ställen i märkningen:
- Mortalitet och sjuklighet i kranskärlssjukdom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Levertoxicitet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Pankreatit [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Överkänslighetsreaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Venotromboembolisk sjukdom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska prövningar
Eftersom kliniska studier utförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska studierna av ett läkemedel inte direkt jämföras med frekvensen i de kliniska studierna av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
Biverkningar som rapporterats av 2 % eller fler av patienterna som behandlats med fenofibrat (och fler än placebo) under de dubbelblinda, placebokontrollerade studierna, oavsett orsakssamband, listas i tabell 1 nedan. Biverkningar ledde till att behandlingen avbröts hos 5,0 % av patienterna som behandlades med fenofibrat och hos 3,0 % som behandlades med placebo. Ökade leverfunktionstester var de vanligaste händelserna, vilket ledde till att fenofibratbehandlingen avbröts hos 1,6 % av patienterna i dubbelblinda studier.
Urtikaria sågs hos 1,1 % vs. 0 % och utslag hos 1,4 % vs. 0,8 % av fenofibrat- respektive placebopatienter i kontrollerade studier.
Ökning av leverenzymer
I en poolad analys av 10 placebokontrollerade studier inträffade ökningar till > 3 gånger den övre normalgränsen i ALAT hos 5,3 % av patienterna som tog fenofibrat i doser motsvarande 96 mg till 145 mg TRICOR dagligen jämfört med 1,1 % av patienterna som behandlades med placebo [ser VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. I en 8-veckors studie var incidensen av ALAT- eller ASAT-höjningar ≥ 3 gånger den övre normalgränsen 13 % hos patienter som fick doser motsvarande 96 mg till 145 mg TRICOR dagligen och var 0 % hos de som fick doser motsvarande 48 mg eller mindre TRICOR dagligen eller placebo.
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats under användning av fenofibrat efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering: myalgi, rabdomyolys, pankreatit, akut njursvikt, muskelspasmer, hepatit, cirros, ökad totalt bilirubin, anemi, artralgi, minskningar av hemoglobin, minskningar av hematokrit, minskningar av vita blodkroppar, asteni, allvarligt sänkta HDL-kolesterolnivåer och interstitiell lungsjukdom. Fotosensitivitetsreaktioner har inträffat dagar till månader efter initiering; i några av dessa fall rapporterade patienter en tidigare ljuskänslighetsreaktion mot ketoprofen.
LÄKEMEDELSINTERAKTIONER
Kumarin antikoagulantia
Potentiering av antikoagulerande effekter av kumarintyp har observerats vid förlängning av PT/INR.
Försiktighet bör iakttas när kumarinantikoagulantia ges i kombination med TRICOR. Dosen av antikoagulantia bör reduceras för att bibehålla PT/INR på önskad nivå för att förhindra blödningskomplikationer. Frekventa PT/INR-bestämningar är tillrådliga tills det definitivt har fastställts att PT/INR har stabiliserats [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Immunsuppressiva medel
Immunsuppressiva medel som ciklosporin och takrolimus kan ge nefrotoxicitet med minskat kreatininclearance och ökat serumkreatinin, och eftersom renal utsöndring är den primära elimineringsvägen för fibratläkemedel inklusive TRICOR, finns det en risk att en interaktion leder till försämring av njurfunktionen. Fördelarna och riskerna med att använda TRICOR (fenofibrattabletter) tillsammans med immunsuppressiva medel och andra potentiellt nefrotoxiska medel bör noggrant övervägas och den lägsta effektiva dosen som används och njurfunktionen övervakas.
Gallsyrabindande hartser
Eftersom gallsyrabindande hartser kan binda andra läkemedel som ges samtidigt, bör patienterna ta TRICOR 200 mg minst 1 timme före eller 4 till 6 timmar efter ett gallsyrabindande harts för att undvika att hindra dess absorption.
Kolchicin
Fall av myopati, inklusive rabdomyolys, har rapporterats med fenofibrat administrerade samtidigt med kolchicin, och försiktighet bör iakttas vid förskrivning av fenofibrat med kolchicin.
VARNINGAR
Ingår som en del av FÖRSIKTIGHETSÅTGÄRDER sektion.
FÖRSIKTIGHETSÅTGÄRDER
Mortalitet och kranskärlssjukdom Morbiditet
Effekten av TRICOR 160 mg på morbiditet och mortalitet i kranskärlssjukdom och icke-kardiovaskulär mortalitet har inte fastställts.
The Action to Control Cardiovascular Risk in Diabetes Lipid (ACCORD Lipid)-studien var en randomiserad placebokontrollerad studie av 5518 patienter med typ 2-diabetes mellitus på bakgrundsbehandling med statiner som behandlats med fenofibrat. Den genomsnittliga uppföljningstiden var 4,7 år. Kombinationsbehandling med fenofibrat plus statin visade en icke-signifikant 8 % relativ riskreduktion i det primära resultatet av allvarliga kardiovaskulära händelser (MACE), en sammansättning av icke-fatal hjärtinfarkt, icke-fatal stroke och dödsfall i hjärt-kärlsjukdom (hazard ratio [hazard ratio] HR] 0,92, 95 % CI 0,79-1,08) (p=0,32) jämfört med statinmonoterapi. I en könsundergruppsanalys var riskkvoten för MACE hos män som fick kombinationsbehandling jämfört med statinmonoterapi 0,82 (95 % KI 0,69–0,99), och riskkvoten för MACE hos kvinnor som fick kombinationsbehandling jämfört med statinmonoterapi var 1,38 (95 % KI) 0,98-1,94) (interaktion p=0,01). Den kliniska betydelsen av detta undergruppsfynd är oklar.
Studien med fenofibratintervention och händelsesänkning vid diabetes (FIELD) var en 5-årig randomiserad, placebokontrollerad studie av 9795 patienter med typ 2-diabetes mellitus behandlade med fenofibrat. Fenofibrat visade en icke-signifikant 11 % relativ minskning av det primära resultatet av koronar hjärtsjukdom (hazard ratio [HR] 0,89, 95 % CI 0,75-1,05, p=0,16) och en signifikant 11 % minskning av det totala sekundära resultatet kardiovaskulära sjukdomshändelser (HR 0,89 [0,80-0,99], p=0,04). Det var en icke-signifikant 11% (HR 1,11 [0,95, 1,29], p=0,18) och 19% (HR 1,19 [0,90, 1,57], p=0,22) ökning av total mortalitet respektive koronar hjärtsjukdom med fenofibrat jämfört med placebo.
På grund av kemiska, farmakologiska och kliniska likheter mellan TRICOR (fenofibrattabletter), klofibrat och gemfibrozil, kan de negativa fynden i 4 stora randomiserade, placebokontrollerade kliniska studier med dessa andra fibratläkemedel även gälla TRICOR.
Coronary Drug Project, en stor studie av post myokardinfarkt hos patienter som behandlats i 5 år med klofibrat, sågs ingen skillnad i dödlighet mellan klofibratgruppen och placebogruppen. Det fanns dock en skillnad i frekvensen av kolelitiasis och kolecystit som krävde kirurgi mellan de två grupperna (3,0 % mot 1,8 %).
en studie utförd av Världshälsoorganisationen (WHO) behandlades 5 000 försökspersoner utan känd kranskärlssjukdom med placebo eller klofibrat i 5 år och följdes i ytterligare ett år. Det fanns en statistiskt signifikant, högre åldersjusterad dödlighet av alla orsaker i klofibratgruppen jämfört med placebogruppen (5,70 % vs. 3,96 %, p =
Helsinki Heart Study var en stor (n=4081) studie av medelålders män utan en historia av kranskärlssjukdom. Försökspersonerna fick antingen placebo eller gemfibrozil i 5 år, med 3,5 års öppen förlängning efteråt. Den totala dödligheten var numeriskt högre i randomiseringsgruppen för gemfibrozil men uppnådde ingen statistisk signifikans (p = 0,19, 95 % konfidensintervall för relativ risk G:P = 0,91-1,64). Även om cancerdödsfall trendade högre i gemfibrozilgruppen (p = 0,11), diagnostiserades cancer (exklusive basalcellscancer) med samma frekvens i båda studiegrupperna. På grund av studiens begränsade storlek visades den relativa risken för dödsfall oavsett orsak inte vara annorlunda än den som sågs i 9-års uppföljningsdata från Världshälsoorganisationens studie (RR=1,29).
En sekundär preventionskomponent i Helsinki Heart Study inkluderade medelålders män som uteslöts från den primära preventionsstudien på grund av känd eller misstänkt kranskärlssjukdom. Försökspersoner fick gemfibrozil eller placebo i 5 år. Även om hjärtdödsfall utvecklades högre i gemfibrozilgruppen, var detta inte statistiskt signifikant (hazard ratio 2,2, 95 % konfidensintervall: 0,94-5,05). Frekvensen av gallblåsoperationer var inte statistiskt signifikant mellan studiegrupperna, men trenden var högre i gemfibrozilgruppen (1,9 % mot 0,3 %, p = 0,07).
Hepatotoxicitet
Allvarlig läkemedelsinducerad leverskada (DILI), inklusive levertransplantation och dödsfall, har rapporterats efter marknadsföring med TRICOR. DILI har rapporterats inom de första veckorna av behandlingen eller efter flera månaders behandling och har i vissa fall vänt efter att behandlingen med TRICOR 200 mg avbrutits. Patienter med DILI har upplevt tecken och symtom inklusive mörk urin, onormal avföring, gulsot, sjukdomskänsla, buksmärtor, myalgi, viktminskning, klåda och illamående. Många patienter hade samtidiga förhöjningar av totalt bilirubin, serumalanintransaminas (ALT) och aspartattransaminas (ASAT). DILI har karakteriserats som hepatocellulär, kronisk aktiv och kolestatisk hepatit, och cirros har förekommit i samband med kronisk aktiv hepatit.
I kliniska prövningar har fenofibrat i doser motsvarande 96 mg till 145 mg TRICOR 160 mg dagligen associerats med ökningar av serum ASAT eller ALAT. Incidensen av ökningar av transaminaser kan vara dosrelaterad [se NEGATIVA REAKTIONER ].
TRICOR 160mg är kontraindicerat hos patienter med aktiv leversjukdom, inklusive de med primär gallcirros och oförklarade ihållande avvikelser i leverfunktionen [se KONTRAINDIKATIONER ]. Övervaka patientens leverfunktion, inklusive serum ALT, ASAT och totalt bilirubin, vid baslinjen och regelbundet under behandlingen med TRICOR. Avbryt TRICOR 200 mg om tecken eller symtom på leverskada utvecklas eller om förhöjda enzymnivåer kvarstår (ALT eller AST > 3 gånger den övre normalgränsen, eller om det åtföljs av förhöjt bilirubin). Starta inte om TRICOR 160mg hos dessa patienter om det inte finns någon alternativ förklaring till leverskadan.
Myopati och rabdomyolys
Fibrater ökar risken för myopati och har associerats med rabdomyolys. Risken för allvarlig muskeltoxicitet verkar vara ökad hos äldre patienter och hos patienter med diabetes, njurinsufficiens eller hypotyreos.
Myopati bör övervägas hos alla patienter med diffusa myalgier, muskelömhet eller -svaghet och/eller markant förhöjda nivåer av kreatinfosfokinas (CPK).
Patienter bör rådas att omedelbart rapportera oförklarlig muskelsmärta, ömhet eller svaghet, särskilt om de åtföljs av sjukdomskänsla eller feber. CPK-nivåer bör utvärderas hos patienter som rapporterar dessa symtom, och behandling med TRICOR 200 mg bör avbrytas om markant förhöjda CPK-nivåer inträffar eller om myopati/myosit misstänks eller diagnostiseras.
Data från observationsstudier indikerar att risken för rabdomyolys ökar när fibrater, särskilt gemfibrozil, administreras samtidigt med en statin. Kombinationen bör undvikas om inte fördelen med ytterligare förändringar i lipidnivåerna sannolikt uppväger den ökade risken för denna läkemedelskombination [se KLINISK FARMAKOLOGI ].
Fall av myopati, inklusive rabdomyolys, har rapporterats med fenofibrater som administreras samtidigt med kolchicin, och försiktighet bör iakttas vid förskrivning av fenofibrat med kolchicin [se LÄKEMEDELSINTERAKTIONER ].
Serum kreatinin
Förhöjningar av serumkreatinin har rapporterats hos patienter på fenofibrat. Dessa förhöjningar tenderar att återgå till baslinjen efter utsättande av fenofibrat. Den kliniska betydelsen av dessa observationer är okänd. Övervaka njurfunktionen hos patienter med nedsatt njurfunktion som tar TRICOR. Njurövervakning bör också övervägas för patienter som tar TRICOR med risk för njurinsufficiens, såsom äldre och patienter med diabetes.
Kolelithiasis
Fenofibrat, liksom klofibrat och gemfibrozil, kan öka kolesterolutsöndringen i gallan, vilket leder till kolelitiasis. Vid misstanke om kolelithiasis är gallblåsstudier indicerade. Behandling med TRICOR 160 mg ska avbrytas om gallsten upptäcks.

Kumarin antikoagulantia
Försiktighet bör iakttas när kumarinantikoagulantia ges i kombination med TRICOR 160 mg på grund av potentieringen av antikoagulerande effekter av kumarintyp för att förlänga protrombintiden/internationellt normaliserat förhållande (PT/INR). För att förhindra blödningskomplikationer rekommenderas frekvent övervakning av PT/INR och dosjustering av antikoagulantia tills PT/INR har stabiliserats [se LÄKEMEDELSINTERAKTIONER ].
Pankreatit
Pankreatit har rapporterats hos patienter som tar fenofibrat, gemfibrozil och klofibrat. Denna förekomst kan representera en bristande effekt hos patienter med svår hypertriglyceridemi, en direkt läkemedelseffekt eller ett sekundärt fenomen som förmedlas genom sten i gallvägarna eller slambildning med obstruktion av den gemensamma gallgången.
Hematologiska förändringar
Mild till måttlig minskning av hemoglobin, hematokrit och vita blodkroppar har observerats hos patienter efter påbörjad fenofibratbehandling. Dessa nivåer stabiliseras emellertid under långtidsadministrering. Trombocytopeni och agranulocytos har rapporterats hos individer som behandlats med fenofibrat. Regelbunden övervakning av antalet röda och vita blodkroppar rekommenderas under de första 12 månaderna av administrering av TRICOR.
Överkänslighetsreaktioner
Akut överkänslighet
Anafylaxi och angioödem har rapporterats efter marknadsföring med fenofibrat. I vissa fall var reaktionerna livshotande och krävde akut behandling. Om en patient utvecklar tecken eller symtom på en akut överkänslighetsreaktion, råd dem att omedelbart söka läkarvård och avbryta behandlingen med fenofibrat.
Fördröjd överkänslighet
Allvarliga kutana biverkningar (SCAR), inklusive Stevens-Johnsons syndrom, toxisk epidermal nekrolys och läkemedelsreaktion med eosinofili och systemiska symtom (DRESS), har rapporterats efter marknadsföring, som inträffat dagar till veckor efter påbörjad behandling med fenofibrat. Fallen av DRESS var associerade med kutana reaktioner (såsom hudutslag eller exfoliativ dermatit) och en kombination av eosinofili, feber, systemisk organpåverkan (njure, lever eller andningsorgan). Avbryt behandlingen med fenofibrat och behandla patienter på lämpligt sätt om SCAR misstänks.
Venotromboembolisk sjukdom
FIELD-studien observerades lungemboli (PE) och djup ventrombos (DVT) i högre frekvenser i fenofibrat- än den placebobehandlade gruppen. Av 9 795 patienter som inkluderades i FIELD var det 4 900 i placebogruppen och 4 895 i fenofibratgruppen. För DVT var det 48 händelser (1 %) i placebogruppen och 67 (1 %) i fenofibratgruppen (p = 0,074); och för PE var det 32 (0,7 %) händelser i placebogruppen och 53 (1 %) i fenofibratgruppen (p = 0,022).
I Coronary Drug Project upplevde en högre andel av klofibratgruppen definitiv eller misstänkt dödlig eller icke-dödlig lungemboli eller tromboflebit än placebogruppen (5,2 % mot 3,3 % efter fem år; p
Paradoxala sänkningar av HDL-kolesterolnivåer
Det har förekommit rapporter efter marknadsföring och kliniska prövningar om allvarliga sänkningar av HDL-kolesterolnivåer (så låga som 2 mg/dL) hos diabetiker och icke-diabetespatienter som påbörjats med fibratbehandling. Minskningen av HDL-C speglas av en minskning av apolipoprotein A1. Denna minskning har rapporterats inträffa inom 2 veckor till år efter påbörjad fibratbehandling. HDL-C-nivåerna förblir undertryckta tills fibratbehandlingen har avbrutits; svaret på utsättande av fibratterapi är snabbt och ihållande. Den kliniska betydelsen av denna minskning av HDL-C är okänd. Det rekommenderas att HDL-C-nivåerna kontrolleras inom de första månaderna efter påbörjad fibratbehandling. Om en allvarligt sänkt HDL-C-nivå upptäcks ska fibratbehandlingen avbrytas och HDL-C-nivån övervakas tills den har återgått till baslinjen, och fibratbehandlingen ska inte återupptas.
Icke-klinisk toxikologi
Karcinogenes och mutagenes och försämring av fertilitet
Två karcinogenicitetsstudier i kosten har utförts på råttor med fenofibrat. I den första 24-månadersstudien doserades Wistar-råttor med fenofibrat i 10, 45 och 200 mg/kg/dag, ungefär 0,3, 1 och 6 gånger den maximala rekommenderade humana dosen (MRHD) på 300 mg fenofibrat dagligen, motsvarande 145 mg TRICOR 160 mg dagligen, baserat på jämförelser av kroppsytan. Vid en dos på 200 mg/kg/dag (vid 6 gånger MRHD) ökade incidensen av leverkarcinom signifikant hos båda könen. En statistiskt signifikant ökning av pankreaskarcinom observerades hos män vid 1 och 6 gånger MRHD; en ökning av bukspottkörteladenom och benigna testikulära interstitiell celltumörer observerades vid 6 gånger MRHD hos män. I en andra 24-månaders karcinogenicitetsstudie på råttor i en annan råttstam (Sprague-Dawley), gav doser på 10 och 60 mg/kg/dag (0,3 och 2 gånger MRHD) signifikanta ökningar av incidensen av pankreas acinära adenom hos båda könen och ökningar av interstitiell celltumör i testiklarna hos män vid 2 gånger MRHD.
En 117-veckors karcinogenicitetsstudie utfördes på råttor som jämförde tre läkemedel: fenofibrat 10 och 60 mg/kg/dag (0,3 och 2 gånger MRHD, baserat på jämförelser av kroppsyta), klofibrat (400 mg/kg/dag; 2 gånger humandosen) och gemfibrozil (250 mg/kg/dag; 2 gånger humandosen, baserat på mg/m² yta). Fenofibrat ökade pankreatiska acinära adenom hos båda könen. Klofibrat ökade hepatocellulärt karcinom och pankreas acinära adenom hos män och leverneoplastiska knölar hos kvinnor. Gemfibrozil ökade neoplastiska knölar i levern hos män och kvinnor, medan alla tre läkemedlen ökade testikulära interstitiell celltumör hos män.
en 21-månaders studie på CF-1 möss ökade fenofibrat 10, 45 och 200 mg/kg/dag (ungefär 0,2, 1 och 3 gånger MRHD, baserat på jämförelser av kroppsytan) signifikant leverkarcinomen i båda kön vid 3 gånger MRHD. I en andra 18-månadersstudie med 10, 60 och 200 mg/kg/dag ökade fenofibrat signifikant leverkarcinomen hos möss av hankön och leveradenom hos honmöss med 3 gånger MRHD.
Elektronmikroskopistudier har visat peroxisomal proliferation efter administrering av fenofibrat till råtta. En adekvat studie för att testa för peroxisomproliferation hos människor har inte gjorts, men förändringar i peroxisommorfologi och antal har observerats hos människor efter behandling med andra medlemmar av fibratklassen när leverbiopsier jämfördes före och efter behandling hos samma individ.
Fenofibrat har visats sakna mutagen potential i följande tester: Ames, muslymfom, kromosomavvikelser och oplanerad DNA-syntes i primära råtthepatocyter.
I fertilitetsstudier fick råttor orala dietdoser av fenofibrat, hanar fick 61 dagar före parning och honor 15 dagar före parning genom avvänjning, vilket inte resulterade i någon negativ effekt på fertiliteten vid doser upp till 300 mg/kg/dag (10 gånger MRHD, baserat på jämförelser av kroppsyta).
Användning i specifika populationer
Graviditet
Risksammanfattning
Begränsade tillgängliga data från användning av fenofibrat hos gravida kvinnor är otillräckliga för att fastställa en läkemedelsassocierad risk för allvarliga fosterskador, missfall eller ogynnsamma resultat hos modern eller foster. I reproduktionsstudier på djur observerades inga tecken på embryo-fetal toxicitet vid oral administrering av fenofibrat till råttor och kaniner under organogenes i doser lägre än eller motsvarande den maximala rekommenderade kliniska dosen på 145 mg dagligen, baserat på kroppsyta (mg/ m²). Skadliga reproduktionseffekter inträffade vid högre doser i närvaro av maternell toxicitet (se Data ). TRICOR 200 mg ska endast användas under graviditet om den potentiella nyttan överväger den potentiella risken för fostret.
Den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall för den indikerade populationen är okänd. I den allmänna befolkningen i USA är den uppskattade bakgrundsrisken för stora fosterskador och missfall i kliniskt erkända graviditeter 2-4% respektive 15-20%.
Data
Djurdata
Hos dräktiga råttor som fick orala dietdoser på 14, 127 och 361 mg/kg/dag från dräktighetsdag 6-15 under organogenesperioden, observerades inga negativa utvecklingsfynd vid 14 mg/kg/dag (mindre än den kliniska exponeringen) vid den maximala rekommenderade humana dosen [MRHD] på 300 mg fenofibrat dagligen, motsvarande 145 mg TRICOR dagligen, baserat på jämförelser av kroppsytan). Ökade fostrets skelettmissbildningar observerades vid maternellt toxiska doser (361 mg/kg/dag, motsvarande 12 gånger den kliniska exponeringen vid MRHD) som signifikant dämpade moderns kroppsviktsökning.
Hos dräktiga kaniner som gavs oral sondmatningsdoser på 15, 150 och 300 mg/kg/dag från dräktighetsdag 618 under organogenesperioden och fick förlossa, observerades inga ogynnsamma utvecklingsfynd vid 15 mg/kg/dag (en dos som approximerar den kliniska exponeringen vid MRHD, baserat på jämförelser av kroppsytan). Aborterade kullar observerades vid maternellt toxiska doser (≥ 150 mg/kg/dag, motsvarande ≥ 10 gånger den kliniska exponeringen vid MRHD) som undertryckte moderns kroppsviktsökning.
Hos dräktiga råttor som fick orala dietdoser på 15, 75 och 300 mg/kg/dag från dräktighetsdag 15 till och med laktationsdag 21 (avvänjning), observerades inga negativa utvecklingseffekter vid 15 mg/kg/dag (mindre än den kliniska exponeringen) vid MRHD, baserat på jämförelser av kroppsyta), trots maternell toxicitet (minskad viktökning). Postimplantationsförlust observerades vid ≥ 75 mg/kg/dag (≥ 2 gånger den kliniska exponeringen vid MRHD) i närvaro av maternell toxicitet (minskad viktökning). Minskad valpöverlevnad noterades vid 300 mg/kg/dag (10 gånger den kliniska exponeringen vid MRHD), vilket var associerat med minskad maternell kroppsviktsökning/försummelse av modern.
Laktation
Risksammanfattning
Det finns ingen tillgänglig information om förekomsten av fenofibrat i bröstmjölk, effekterna av läkemedlet på det ammade barnet eller effekterna på mjölkproduktionen. Fenofibrat finns i mjölken hos råttor och är därför troligtvis närvarande i bröstmjölk. På grund av risken för allvarliga biverkningar hos spädbarn som ammas, såsom störningar av spädbarns lipidmetabolism, bör kvinnor inte amma under behandling med TRICOR 200 mg och under 5 dagar efter den sista dosen [se KONTRAINDIKATIONER ].
Pediatrisk användning
Säkerhet och effektivitet har inte fastställts hos pediatriska patienter.
Geriatrisk användning
Det är känt att fenofibrinsyra utsöndras till stor del via njurarna, och risken för biverkningar av detta läkemedel kan vara större hos patienter med nedsatt njurfunktion. Fenofibrinsyraexponering påverkas inte av ålder. Eftersom äldre patienter har en högre incidens av nedsatt njurfunktion, bör dosval för äldre göras på basis av njurfunktionen [se DOSERING OCH ADMINISTRERING och KLINISK FARMAKOLOGI ]. Äldre patienter med normal njurfunktion bör inte behöva några dosjusteringar. Överväg att övervaka njurfunktionen hos äldre patienter som tar TRICOR.
Nedsatt njurfunktion
Användning av TRICOR 160 mg bör undvikas hos patienter som har gravt nedsatt njurfunktion [se KONTRAINDIKATIONER ]. Dosreduktion krävs hos patienter med lätt till måttligt nedsatt njurfunktion [se DOSERING OCH ADMINISTRERING och KLINISK FARMAKOLOGI ]. Övervakning av njurfunktionen hos patienter med nedsatt njurfunktion rekommenderas.
Nedsatt leverfunktion
Användningen av TRICOR 200 mg har inte utvärderats hos patienter med nedsatt leverfunktion [se KONTRAINDIKATIONER och KLINISK FARMAKOLOGI ].
ÖVERDOS
Det finns ingen specifik behandling för överdosering med TRICOR. Allmän stödjande vård av patienten är indicerad, inklusive övervakning av vitala tecken och observation av klinisk status, om en överdos skulle inträffa. Om indikerat, bör eliminering av oabsorberat läkemedel uppnås genom kräkning eller magsköljning; vanliga försiktighetsåtgärder bör iakttas för att bibehålla luftvägarna. Eftersom fenofibrinsyra är starkt bundet till plasmaproteiner bör hemodialys inte övervägas.
KONTRAINDIKATIONER
TRICOR 200mg är kontraindicerat vid:
- patienter med gravt nedsatt njurfunktion, inklusive de som får dialys [se KLINISK FARMAKOLOGI ].
- patienter med aktiv leversjukdom, inklusive de med primär biliär cirros och oförklarade ihållande leverfunktionsavvikelser [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- patienter med redan existerande gallblåsasjukdom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- ammande mödrar [se Användning i specifika populationer ].
- patienter med känd överkänslighet mot fenofibrat eller fenofibrinsyra [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
KLINISK FARMAKOLOGI
Handlingsmekanism
Den aktiva delen av TRICOR är fenofibrinsyra. De farmakologiska effekterna av fenofibrinsyra hos både djur och människor har studerats omfattande genom oral administrering av fenofibrat.
De lipidmodifierande effekterna av fenofibrinsyra som ses i klinisk praxis har förklarats in vivo i transgena möss och in vitro i humana hepatocytkulturer genom aktiveringen av peroxisomproliferatoraktiverad receptor α (PPARα). Genom denna mekanism ökar fenofibrat lipolys och eliminering av triglyceridrika partiklar från plasma genom att aktivera lipoproteinlipas och minska produktionen av apoprotein C-III (en hämmare av lipoproteinlipasaktivitet).
Den resulterande minskningen av TG ger en förändring i storleken och sammansättningen av LDL från små, täta partiklar (som tros vara aterogena på grund av deras känslighet för oxidation) till stora flytande partiklar. Dessa större partiklar har en större affinitet för kolesterolreceptorer och kataboliseras snabbt. Aktivering av PPARa inducerar också en ökning av syntesen av apolipoproteinerna AI, A-II och HDL-kolesterol.
Fenofibrat minskar också serumurinsyranivåerna hos hyperurikemiska och normala individer genom att öka urinutsöndringen av urinsyra.
Farmakodynamik
En mängd olika kliniska studier har visat att förhöjda nivåer av total-C, LDL-C och apo B, ett LDL-membrankomplex, är associerade med human ateroskleros. På liknande sätt är minskade nivåer av HDL-C och dess transportkomplex, apolipoprotein A (apo AI och apo AII) associerade med utvecklingen av ateroskleros. Epidemiologiska undersökningar har fastställt att kardiovaskulär morbiditet och mortalitet varierar direkt med nivån av total-C, LDL-C och TG, och omvänt med nivån av HDL-C. Den oberoende effekten av att höja HDL-C eller sänka triglycerider (TG) på risken för kardiovaskulär sjuklighet och mortalitet har inte fastställts.
Fenofibrinsyra, den aktiva metaboliten av fenofibrat, ger minskningar av totalt kolesterol, LDL-kolesterol, apolipoprotein B, totala triglycerider och triglyceridrikt lipoprotein (VLDL) hos behandlade patienter. Dessutom resulterar behandling med fenofibrat i ökningar av högdensitetslipoprotein (HDL) och apolipoproteinerna apoAI och apoAII.
Farmakokinetik
Plasmakoncentrationer av fenofibrinsyra efter administrering av tre 48 mg eller en 145 mg tabletter motsvarar under matningsförhållanden en 200 mg mikroniserad fenofibratkapsel.
Fenofibrat är en prodrug av den aktiva kemiska delen fenofibrinsyra. Fenofibrat omvandlas genom esterhydrolys i kroppen till fenofibrinsyra som är den aktiva beståndsdelen som kan mätas i cirkulationen.
Absorption
Den absoluta biotillgängligheten för fenofibrat kan inte bestämmas eftersom föreningen är praktiskt taget olöslig i vattenhaltiga medier lämpliga för injektion. Fenofibrat absorberas dock väl från mag-tarmkanalen. Efter oral administrering till friska frivilliga uppträdde cirka 60 % av en engångsdos av radiomärkt fenofibrat i urinen, främst som fenofibrinsyra och dess glukuronatkonjugat, och 25 % utsöndrades i feces. Maximala plasmanivåer av fenofibrinsyra inträffar inom 6 till 8 timmar efter administrering.
Exponeringen för fenofibrinsyra i plasma, mätt som Cmax och AUC, skiljer sig inte signifikant när en engångsdos på 145 mg fenofibrat administreras under fasta eller icke-fastande.
Distribution
Vid upprepad dosering av fenofibrat uppnås fenofibrinsyra steady state inom 9 dagar. Plasmakoncentrationerna av fenofibrinsyra vid steady state är ungefär dubbelt så höga som efter en engångsdos. Serumproteinbindningen var cirka 99 % hos normala och hyperlipidemiska patienter.
Ämnesomsättning
Efter oral administrering hydrolyseras fenofibrat snabbt av esteraser till den aktiva metaboliten fenofibrinsyra; inget oförändrat fenofibrat detekteras i plasma.
Fenofibrinsyra konjugeras i första hand med glukuronsyra och utsöndras sedan i urinen. En liten mängd fenofibrinsyra reduceras vid karbonyldelen till en benshydrolmetabolit som i sin tur konjugeras med glukuronsyra och utsöndras i urinen.
In vivo-metabolismdata indikerar att varken fenofibrat eller fenofibrinsyra genomgår oxidativ metabolism (t.ex. cytokrom P450) i betydande utsträckning.
Eliminering
Efter absorption utsöndras fenofibrat huvudsakligen i urinen i form av metaboliter, främst fenofibrinsyra och fenofibrinsyraglukuronid. Efter administrering av radiomärkt fenofibrat uppträdde cirka 60 % av dosen i urinen och 25 % utsöndrades i feces.
Fenofibrinsyra elimineras med en halveringstid på 20 timmar, vilket tillåter dosering en gång dagligen.
Särskilda populationer
Geriatri
Hos äldre frivilliga i åldern 77 till 87 år var det orala clearance av fenofibrinsyra efter en oral engångsdos av fenofibrat 1,2 l/timme, vilket kan jämföras med 1,1 l/timme hos unga vuxna. Detta indikerar att en liknande dosregim kan användas till äldre med normal njurfunktion utan att öka ackumuleringen av läkemedlet eller metaboliter [se DOSERING OCH ADMINISTRERING och Användning i specifika populationer ].
Pediatrik
Farmakokinetiken för TRICOR 160 mg har inte studerats i pediatriska populationer.
Kön
Ingen farmakokinetisk skillnad mellan män och kvinnor har observerats för fenofibrat.
Lopp
Inverkan av ras på fenofibrats farmakokinetik har inte studerats, men fenofibrat metaboliseras inte av enzymer som är kända för att uppvisa interetnisk variation.
Nedsatt njurfunktion
Farmakokinetiken för fenofibrinsyra undersöktes hos patienter med mild, måttlig och gravt nedsatt njurfunktion. Patienter med gravt nedsatt njurfunktion (uppskattad glomerulär filtrationshastighet [eGFR] DOSERING OCH ADMINISTRERING ].
Nedsatt leverfunktion
Inga farmakokinetiska studier har utförts på patienter med nedsatt leverfunktion.
Läkemedelsinteraktioner
In vitro-studier med humana levermikrosomer indikerar att fenofibrat och fenofibrinsyra inte är hämmare av cytokrom (CYP) P450 isoformerna CYP3A4, CYP2D6, CYP2E1 eller CYP1A2. De är svaga hämmare av CYP2C8, CYP2C19 och CYP2A6, och milda till måttliga hämmare av CYP2C9 vid terapeutiska koncentrationer.
Tabell 2 beskriver effekterna av samtidigt administrerade läkemedel på systemisk exponering för fenofibrinsyra. Tabell 3 beskriver effekterna av samtidigt administrerat fenofibrat eller fenofibrinsyra på andra läkemedel.
Kliniska studier
Primär hyperkolesterolemi (heterozygot familjär och icke-familj) och blandad dyslipidemi
Effekterna av fenofibrat vid en dos motsvarande 145 mg TRICOR (fenofibrattabletter) per dag utvärderades från fyra randomiserade, placebokontrollerade, dubbelblinda parallellgruppsstudier inklusive patienter med följande genomsnittliga lipidvärden: total-C 306,9 mg/dL; LDL-C 213,8 mg/dL; HDL-C 52,3 mg/dL; och triglycerider 191,0 mg/dL. TRICOR 200 mg-behandling sänkte LDL-C, Total-C och LDL-C/HDL-C-kvoten. TRICOR-terapi sänkte också triglycerider och höjde HDL-C (se tabell 4).
I en delmängd av försökspersonerna utfördes mätningar av apo B. Behandling med TRICOR 200 mg reducerade signifikant apo B från baslinje till effektmått jämfört med placebo (-25,1 % vs. 2,4 %, p
Svår hypertriglyceridemi
Effekterna av fenofibrat på serumtriglycerider studerades i två randomiserade, dubbelblinda, placebokontrollerade kliniska studier med 147 hypertriglyceridemiska patienter. Patienterna behandlades i åtta veckor enligt protokoll som endast skilde sig åt genom att den ena kom in i patienter med TG-nivåer från 500 till 1500 mg/dL och den andra TG-nivåer på 350 till 500 mg/dL. Hos patienter med hypertriglyceridemi och normal kolesterolemi med eller utan hyperkylomikronemi, minskade behandling med fenofibrat i doser motsvarande TRICOR 145 mg per dag i första hand triglycerider med mycket låg densitet lipoprotein (VLDL) och VLDL-kolesterol. Behandling av patienter med förhöjda triglycerider resulterar ofta i en ökning av LDL-C (se tabell 5).
Effekten av TRICOR 160 mg på kardiovaskulär sjuklighet och mortalitet har inte fastställts.
PATIENTINFORMATION
Patienter bör informeras om:
- av de potentiella fördelarna och riskerna med TRICOR.
- att inte använda TRICOR om det finns en känd överkänslighet mot fenofibrat eller fenofibrinsyra.
- av mediciner som inte bör tas i kombination med TRICOR.
- att om de tar kumarinantikoagulantia kan TRICOR 160 mg öka deras antikoagulerande effekt och ökad övervakning kan vara nödvändig.
- att fortsätta följa en lämplig lipidmodifierande diet medan du tar TRICOR.
- att ta TRICOR 160 mg en gång dagligen, utan hänsyn till mat, i den föreskrivna dosen, svälja varje tablett hel.
- att återvända till sin läkares kontor för rutinövervakning.
- att informera sin läkare om alla mediciner, kosttillskott och växtbaserade preparat de tar och alla förändringar av deras medicinska tillstånd. Patienter bör också rådas att informera sina läkare som skriver ut ett nytt läkemedel att de tar TRICOR.
- att informera sin läkare om symtom på leverskada (t.ex. gulsot, buksmärtor, illamående, sjukdomskänsla, mörk urin, onormal avföring, klåda); någon muskelsmärta, ömhet eller svaghet; eller andra nya symtom.
- att inte amma under behandling med TRICOR och i 5 dagar efter den sista dosen.
