Crestor 10mg, 20mg, 5mg Rosuvastatin Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Crestor och hur används det?
Crestor är ett receptbelagt läkemedel som används för att sänka LDL-kolesterol (lågdensitetslipoprotein) och triglycerider i blodet, bromsa utvecklingen av plack i blodkärlen, minska risken för stroke och hjärtinfarkt. Crestor 20 mg kan användas ensamt eller tillsammans med andra läkemedel.
Crestor är ett lipidsänkande medel, statiner, HMG-CoA-reduktashämmare.
Det är inte känt om Crestor är säkert och effektivt för barn yngre än 8 år.
Vilka är de möjliga biverkningarna av Crestor?
Crestor kan orsaka allvarliga biverkningar inklusive:
- oförklarlig muskelsmärta
- muskelömhet
- muskelsvaghet
- förvirring
- minnesproblem
- ont i övre magen
- trötthet
- aptitlöshet
- mörk urin
- gulfärgning av hud eller ögon (gulsot)
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Crestor inkluderar:
- huvudvärk
- svaghet
- muskelvärk
- illamående
- magont
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Crestor. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
CRESTOR (rosuvastatinkalcium) är ett syntetiskt lipidsänkande medel för oral administrering.
Det kemiska namnet för rosuvastatinkalcium är bis[(E)-7-[4-(4-fluorfenyl)-6-isopropyl-2-[metyl(metylsulfonyl)amino]pyrimidin-5-yl](3R,5S)-3 ,5-dihydroxihept-6-ensyra] kalciumsalt med följande strukturformel:
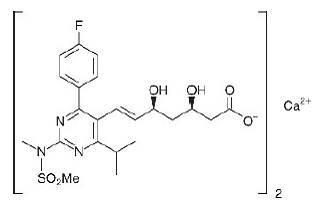
Den empiriska formeln för rosuvastatinkalcium är (C22H27FN3O6S)2Ca och molekylvikten är 1001,14. Rosuvastatinkalcium är ett vitt amorft pulver som är svårlösligt i vatten och metanol och något lösligt i etanol. Rosuvastatinkalcium är en hydrofil förening med en fördelningskoefficient (oktanol/vatten) på 0,13 vid pH 7,0.
CRESTOR tabletter för oral administrering innehåller 5, 10, 20 eller 40 mg rosuvastatin och följande inaktiva ingredienser: Varje tablett innehåller: mikrokristallin cellulosa NF, laktosmonohydrat NF, tribasiskt kalciumfosfat NF, krospovidon NF, magnesiumstearat NF, hypromellos triacetin NF, titandioxid USP, gul järnoxid och röd järnoxid NF.
INDIKATIONER
Hyperlipidemi och blandad dyslipidemi
CRESTOR är indicerat som tilläggsterapi till kosten för att minska förhöjda total-C, LDL-C, ApoB, icke-HDL-C och triglycerider och för att öka HDL-C hos vuxna patienter med primär hyperlipidemi eller blandad dyslipidemi. Lipidförändrande medel bör användas utöver en diet som är begränsad i mättat fett och kolesterol när responsen på enbart diet och icke-farmakologiska ingrepp har varit otillräcklig.
Pediatriska patienter med familjär hyperkolesterolemi
CRESTOR 10mg är indicerat som ett komplement till diet för att:
- minska total-C, LDL-C och ApoB-nivåerna hos barn och ungdomar i åldern 8 till 17 år med heterozygot familjär hyperkolesterolemi om följande fynd är närvarande efter en adekvat prövning av dietbehandling: LDL-C >190 mg/dL, eller >160 mg/dL tillsammans med en positiv familjehistoria av prematur kardiovaskulär sjukdom (CVD) eller två eller flera andra CVD-riskfaktorer.
- minska LDL-C, Total-C, nonHDL-C och ApoB hos barn och ungdomar 7 till 17 år med homozygot familjär hyperkolesterolemi, antingen ensamt eller tillsammans med andra lipidsänkande behandlingar (t.ex. LDL-aferes).
Hypertriglyceridemi
CRESTOR är indicerat som tilläggsterapi till diet för behandling av vuxna patienter med hypertriglyceridemi.
Primär dysbetalipoproteinemi (typ III hyperlipoproteinemi)
CRESTOR är indicerat som ett komplement till diet för behandling av vuxna patienter med primär dysbetalipoproteinemi (typ III hyperlipoproteinemi).
Vuxna patienter med homozygot familjär hyperkolesterolemi
CRESTOR är indicerat som tilläggsbehandling till andra lipidsänkande behandlingar (t.ex. LDL-aferes) eller ensamt om sådana behandlingar inte är tillgängliga för att minska LDL-C, Total-C och ApoB hos vuxna patienter med homozygot familjär hyperkolesterolemi.
Bromsning av utvecklingen av åderförkalkning
CRESTOR 5mg är indicerat som tilläggsbehandling till kosten för att bromsa progressionen av ateroskleros hos vuxna patienter som en del av en behandlingsstrategi för att sänka total-C och LDL-C till målnivåerna.
Primärt förebyggande av kardiovaskulära sjukdomar
Hos individer utan kliniskt påvisad kranskärlssjukdom men med en ökad risk för hjärt-kärlsjukdom baserat på ålder ≥50 år hos män och ≥60 år hos kvinnor, hsCRP ≥2 mg/L och förekomsten av minst en ytterligare hjärt-kärlsjukdom riskfaktor såsom högt blodtryck, lågt HDL-C, rökning eller en familjehistoria av för tidig kranskärlssjukdom, CRESTOR är indicerat för att:
- minska risken för stroke
- minska risken för hjärtinfarkt
- minska risken för arteriell revaskularisering
Användningsbegränsningar
CRESTOR har inte studerats vid Fredrickson typ I och V dyslipidemier.
DOSERING OCH ADMINISTRERING
Allmän doseringsinformation
Dosintervallet för CRESTOR 5 mg till vuxna är 5 till 40 mg oralt en gång dagligen. Den vanliga startdosen är 10 till 20 mg en gång dagligen. Den vanliga startdosen för vuxna patienter med homozygot familjär hyperkolesterolemi är 20 mg en gång dagligen.
Den maximala CRESTOR 20 mg dosen på 40 mg bör endast användas för de patienter som inte har uppnått sitt LDL-C-mål genom att använda dosen 20 mg [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
CRESTOR 5 mg kan administreras som en engångsdos när som helst på dygnet, med eller utan mat. Tabletten ska sväljas hel.
Vid initiering av CRESTOR-behandling eller byte från en annan behandling med HMG-CoA-reduktashämmare, bör lämplig startdos på 10 mg CRESTOR först användas och först därefter titreras enligt patientens svar och individuella mål för behandlingen.
Efter påbörjad eller efter titrering av CRESTOR bör lipidnivåerna analyseras inom 2 till 4 veckor och dosen justeras därefter.
Pediatrisk dosering
Vid heterozygot familjär hyperkolesterolemi är det rekommenderade dosintervallet 5 till 10 mg oralt en gång dagligen hos patienter 8 till under 10 år och 5 till 20 mg oralt en gång dagligen hos patienter 10 till 17 år.
Vid homozygot familjär hyperkolesterolemi är den rekommenderade dosen 20 mg oralt en gång dagligen hos patienter i åldern 7 till 17 år.
Dosering hos asiatiska patienter
Hos asiatiska patienter, överväg att påbörja behandling med CRESTOR 20 mg med 5 mg en gång dagligen på grund av ökade plasmakoncentrationer av rosuvastatin. Den ökade systemiska exponeringen bör beaktas vid behandling av asiatiska patienter som inte är tillräckligt kontrollerade vid doser upp till 20 mg/dag [se Användning i specifika populationer och KLINISK FARMAKOLOGI ].
Används med samtidig terapi
Patienter som tar cyklosporin
Dosen av CRESTOR 20 mg bör inte överstiga 5 mg en gång dagligen [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , LÄKEMEDELSINTERAKTIONER och KLINISK FARMAKOLOGI ].
Patienter som tar Gemfibrozil
Undvik samtidig användning av CRESTOR och gemfibrozil. Om samtidig användning inte kan undvikas, påbörja CRESTOR med 5 mg en gång dagligen. Dosen av CRESTOR bör inte överstiga 10 mg en gång dagligen [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , LÄKEMEDELSINTERAKTIONER och KLINISK FARMAKOLOGI ].
Patienter som tar Atazanavir och ritonavir, lopinavir och ritonavir eller simeprevir
Inled CRESTOR 10 mg-behandling med 5 mg en gång dagligen. Dosen av CRESTOR bör inte överstiga 10 mg en gång dagligen [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , LÄKEMEDELSINTERAKTIONER och KLINISK FARMAKOLOGI ].
Dosering hos patienter med gravt nedsatt njurfunktion
För patienter med gravt nedsatt njurfunktion (CLcr Användning i specifika populationer och KLINISK FARMAKOLOGI ].
HUR LEVERERAS
Doseringsformer och styrkor
5 mg: Gula, runda, bikonvexa, dragerade tabletter. "CRESTOR" och "5" präglade på ena sidan av tabletten.
10 mg: Rosa, runda, bikonvexa, dragerade tabletter. "CRESTOR" och "10" präglade på ena sidan av tabletten.
20 mg: Rosa, runda, bikonvexa, dragerade tabletter. "CRESTOR" och "20" präglade på ena sidan av tabletten.
40 mg: Rosa, ovala, bikonvexa, dragerade tabletter. "CRESTOR" präglat på ena sidan och "40" på den andra sidan av tabletten.
Förvaring Och Hantering
CRESTOR® (rosuvastatinkalcium) tabletter levereras som:
NDC 0310-0755-90: 5 mg. Gula, runda, bikonvexa, dragerade tabletter. "CRESTOR" och "5" präglade på ena sidan; flaska med 90 tabletter
NDC 0310-0751-90: 10 mg. Rosa, runda, bikonvexa, dragerade tabletter. "CRESTOR" och "10" präglade på ena sidan; flaska med 90 tabletter
NDC 0310-0751-39: 10 mg. Rosa, runda, bikonvexa, dragerade tabletter. "CRESTOR" och "10" präglade på ena sidan; enhetsdosförpackningar om 100 st
NDC 0310-0752-90: 20 mg. Rosa, runda, bikonvexa, dragerade tabletter. "CRESTOR" och "20" präglade på ena sidan; flaskor med 90 st
NDC 0310-0752-39: 20 mg. Rosa, runda, bikonvexa, dragerade tabletter. "CRESTOR" och "20" präglade på ena sidan; enhetsdosförpackningar om 100 st
NDC 0310-0754-30: 40 mg. Rosa, ovala, bikonvexa, belagda tabletter. "CRESTOR" präglad på ena sidan och "40" på andra sidan; flaskor med 30 st
Lagring
Förvara i kontrollerad rumstemperatur, 20-25°C (68-77°F) [se USP-kontrollerad rumstemperatur ]. Skydda mot fukt.
Distribuerat av: AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. Reviderad: sep 2018
BIEFFEKTER
Följande allvarliga biverkningar diskuteras mer i detalj i andra avsnitt av etiketten:
- Rabdomyolys med myoglobinuri och akut njursvikt och myopati (inklusive myosit) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Leverenzymavvikelser [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska studier
Eftersom kliniska studier utförs under mycket varierande förhållanden, kan biverkningsfrekvenser som observerats i de kliniska studierna av ett läkemedel inte direkt jämföras med frekvensen i de kliniska studierna av ett annat läkemedel och återspeglar kanske inte frekvensen som observerats i klinisk praxis.
I databasen för CRESTOR kontrollerade kliniska prövningar (placebo eller aktivt kontrollerade) med 5394 patienter med en genomsnittlig behandlingstid på 15 veckor, avbröt 1,4 % av patienterna behandlingen på grund av biverkningar. De vanligaste biverkningarna som ledde till att behandlingen avbröts var:
- muskelvärk
- buksmärtor
- illamående
De vanligaste rapporterade biverkningarna (incidens ≥2%) i databasen CRESTOR 5 mg kontrollerade kliniska prövningar med 5394 patienter var:
- huvudvärk
- muskelvärk
- buksmärtor
- asteni
- illamående
Biverkningar som rapporterats hos ≥2 % av patienterna i placebokontrollerade kliniska studier och i en högre frekvens än placebo visas i Tabell 1. Dessa studier hade en behandlingstid på upp till 12 veckor.
Andra biverkningar som rapporterats i kliniska studier var buksmärtor, yrsel, överkänslighet (inklusive hudutslag, klåda, urtikaria och angioödem) och pankreatit. Följande laboratorieavvikelser har också rapporterats: dipstick-positiv proteinuri och mikroskopisk hematuri [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]; förhöjt kreatinfosfokinas, transaminaser, glukos, glutamyltranspeptidas, alkaliskt fosfatas och bilirubin; och avvikelser i sköldkörtelfunktionen.
METEOR-studien, som involverade 981 deltagare behandlade med rosuvastatin 40 mg (n=700) eller placebo (n=281) med en genomsnittlig behandlingstid på 1,7 år, 5,6 % av patienterna som behandlades med CRESTOR 5 mg jämfört med 2,8 % av de placebobehandlade försökspersonerna avbröts på grund av biverkningar. De vanligaste biverkningarna som ledde till att behandlingen avbröts var: myalgi, ökat leverenzym, huvudvärk och illamående [se Kliniska studier ].
Biverkningar som rapporterats hos ≥2 % av patienterna och i en frekvens som är högre än placebo visas i Tabell 2.
I JUPITER-studien behandlades 17 802 deltagare med rosuvastatin 20 mg (n=8901) eller placebo (n=8901) under en genomsnittlig varaktighet av 2 år. En högre procentandel av rosuvastatinbehandlade patienter jämfört med placebobehandlade patienter, 6,6 % respektive 6,2 %, avbröt studiemedicinen på grund av en biverkning, oavsett orsakssamband. Myalgi var den vanligaste biverkningen som ledde till att behandlingen avbröts.
JUPITER rapporterades en signifikant högre frekvens av diabetes mellitus hos patienter som tog rosuvastatin (2,8 %) jämfört med patienter som fick placebo (2,3 %). Medelvärdet för HbA1c ökade signifikant med 0,1 % hos rosuvastatinbehandlade patienter jämfört med placebobehandlade patienter. Antalet patienter med HbA1c >6,5 % i slutet av studien var signifikant högre hos rosuvastatinbehandlade jämfört med placebobehandlade patienter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Kliniska studier ].
Biverkningar som rapporterats hos ≥2 % av patienterna och i en frekvens som är högre än placebo visas i Tabell 3.
Pediatriska patienter med heterozygot familjär hyperkolesterolemi
I en 12-veckors kontrollerad studie på pojkar och postmenarkala flickor 10 till 17 år med heterozygot familjär hyperkolesterolemi med CRESTOR 5 till 20 mg dagligen [se Användning i specifika populationer och Kliniska studier ], förhöjda serumkreatinfosfokinas (CK) >10 x ULN observerades oftare hos rosuvastatin jämfört med placebobehandlade barn. Fyra av 130 (3%) barn som behandlats med rosuvastatin (2 behandlade med 10 mg och 2 behandlade med 20 mg) hade ökat CK >10 x ULN, jämfört med 0 av 46 barn på placebo.
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats under användning av CRESTOR efter godkännande: artralgi, fatal och icke-fatal leversvikt, hepatit, gulsot, trombocytopeni, depression, sömnstörningar (inklusive sömnlöshet och mardrömmar), perifer neuropati, interstitiell lungsjukdom och gynekomasti. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering.
Det har förekommit sällsynta rapporter om immunmedierad nekrotiserande myopati i samband med statinanvändning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Det har förekommit sällsynta rapporter om kognitiv funktionsnedsättning (t.ex. minnesförlust, glömska, minnesförlust, minnesstörning och förvirring) i samband med användning av statiner efter marknadsföring. Dessa kognitiva problem har rapporterats för alla statiner. Rapporterna är i allmänhet oseriösa och reversibla vid utsättning av statin, med varierande tider till symtomdebut (1 dag till år) och symtomupplösning (median 3 veckor).
LÄKEMEDELSINTERAKTIONER
Cyklosporin
Cyklosporin ökade exponeringen för rosuvastatin och kan leda till ökad risk för myopati. Hos patienter som tar ciklosporin bör dosen av CRESTOR 10 mg därför inte överstiga 5 mg en gång dagligen [se DOSERING OCH ADMINISTRERING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och KLINISK FARMAKOLOGI ].
Gemfibrozil
Gemfibrozil ökade signifikant exponeringen för rosuvastatin. På grund av en observerad ökad risk för myopati/rabdomyolys bör kombinationsbehandling med CRESTOR och gemfibrozil undvikas. Om de används tillsammans ska dosen av CRESTOR 10 mg inte överstiga 10 mg en gång dagligen [se KLINISK FARMAKOLOGI ].
Proteashämmare
Samtidig administrering av rosuvastatin med vissa proteashämmare har olika effekter på rosuvastatinexponeringen och kan öka risken för myopati. Simeprevir, som är en hepatit C-virus (HCV) proteashämmare, eller kombinationer av atazanavir/ritonavir eller lopinavir/ritonavir, som är HIV-1 proteashämmare, ökar exponeringen för rosuvastatin [se tabell 4 - KLINISK FARMAKOLOGI ]. För dessa proteashämmare bör dosen av CRESTOR 5 mg inte överstiga 10 mg en gång dagligen. Kombinationerna av fosamprenavir/ritonavir eller tipranavir/ritonavir, som är hiv-1-proteashämmare, ger liten eller ingen förändring i exponeringen för rosuvastatin. Försiktighet bör iakttas när rosuvastatin administreras samtidigt med proteashämmare [se DOSERING OCH ADMINISTRERING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och KLINISK FARMAKOLOGI ].
Kumarin antikoagulantia
CRESTOR 20 mg ökade signifikant INR hos patienter som fick kumarinantikoagulantia. Därför bör försiktighet iakttas när kumarinantikoagulantia ges i kombination med CRESTOR. Hos patienter som tar kumarinantikoagulantia och CRESTOR samtidigt, bör INR bestämmas innan CRESTOR påbörjas och tillräckligt ofta under tidig behandling för att säkerställa att ingen signifikant förändring av INR inträffar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och KLINISK FARMAKOLOGI ].
Niacin
Risken för skelettmuskeleffekter kan öka när CRESTOR 5 mg används i kombination med lipidmodifierande doser (≥1 g/dag) av niacin; försiktighet bör iakttas vid förskrivning med CRESTOR [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Fenofibrat
När CRESTOR 20 mg administrerades samtidigt med fenofibrat, observerades ingen kliniskt signifikant ökning av AUC för rosuvastatin eller fenofibrat. Eftersom det är känt att risken för myopati under behandling med HMG-CoA-reduktashämmare ökar vid samtidig användning av fenofibrater, bör försiktighet iakttas vid förskrivning av fenofibrater med CRESTOR [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och KLINISK FARMAKOLOGI ].
Kolchicin
Fall av myopati, inklusive rabdomyolys, har rapporterats med HMG-CoA-reduktashämmare, inklusive rosuvastatin, samtidigt administrerat med kolchicin, och försiktighet bör iakttas vid förskrivning av CRESTOR med kolchicin [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
VARNINGAR
Ingår som en del av FÖRSIKTIGHETSÅTGÄRDER sektion.
FÖRSIKTIGHETSÅTGÄRDER
Skelettmuskeleffekter
Fall av myopati och rabdomyolys med akut njursvikt sekundärt till myoglobinuri har rapporterats med HMG-CoA-reduktashämmare, inklusive CRESTOR. Dessa risker kan uppstå vid vilken dosnivå som helst, men ökar vid den högsta dosen (40 mg).
CRESTOR 5 mg ska förskrivas med försiktighet till patienter med predisponerande faktorer för myopati (t.ex. ålder ≥65 år, otillräckligt behandlad hypotyreos, nedsatt njurfunktion). Risken för myopati under behandling med CRESTOR 5 mg kan öka vid samtidig administrering av vissa andra lipidsänkande behandlingar (fibrater eller niacin), gemfibrozil, ciklosporin, atazanavir/ritonavir, lopinavir/ritonavir eller simeprevir [se DOSERING OCH ADMINISTRERING och LÄKEMEDELSINTERAKTIONER ]. Fall av myopati, inklusive rabdomyolys, har rapporterats med HMG-CoA-reduktashämmare, inklusive rosuvastatin, administrerat samtidigt med kolchicin, och försiktighet bör iakttas vid förskrivning av CRESTOR med kolchicin [se LÄKEMEDELSINTERAKTIONER ].
Behandlingen med CRESTOR ska avbrytas om markant förhöjda kreatinkinasnivåer inträffar eller om myopati diagnostiseras eller misstänks. Behandling med CRESTOR 5 mg bör också tillfälligt avbrytas hos alla patienter med ett akut, allvarligt tillstånd som tyder på myopati eller predisponerar för utveckling av njursvikt sekundärt till rabdomyolys (t.ex. sepsis, hypotoni, uttorkning, större operationer, trauma, svår metabolisk, endokrin, och elektrolytrubbningar eller okontrollerade anfall).
Det har förekommit sällsynta rapporter om immunmedierad nekrotiserande myopati (IMNM), en autoimmun myopati, associerad med statinanvändning. IMNM kännetecknas av: proximal muskelsvaghet och förhöjt serumkreatinkinas, som kvarstår trots att statinbehandlingen avbryts; muskelbiopsi som visar nekrotiserande myopati utan signifikant inflammation; förbättring med immunsuppressiva medel.
Alla patienter bör rådas att omedelbart rapportera oförklarad muskelsmärta, ömhet eller svaghet till sin läkare, särskilt om de åtföljs av sjukdomskänsla eller feber eller om muskeltecken och symtom kvarstår efter att behandlingen med CRESTOR avslutats.
Leverenzymavvikelser
Det rekommenderas att leverenzymetester utförs innan behandling med CRESTOR 10 mg påbörjas och om tecken eller symtom på leverskada uppstår.
Ökning av serumtransaminaser [ASAT (SGOT) eller ALAT (SGPT)] har rapporterats med HMG-CoA-reduktashämmare, inklusive CRESTOR. I de flesta fall var förhöjningarna övergående och försvann eller förbättrades vid fortsatt behandling eller efter ett kort avbrott i behandlingen. Det fanns två fall av gulsot, för vilka ett samband med CRESTOR-behandling inte kunde fastställas, som försvann efter avslutad behandling. Det fanns inga fall av leversvikt eller irreversibel leversjukdom i dessa studier. I en poolad analys av placebokontrollerade studier inträffade ökningar av serumtransaminaser till >3 gånger den övre normalgränsen hos 1,1 % av patienterna som tog CRESTOR 5 mg jämfört med 0,5 % av patienterna som behandlades med placebo.
Det har förekommit sällsynta rapporter efter marknadsföring av fatal och icke-fatal leversvikt hos patienter som tar statiner, inklusive rosuvastatin. Om allvarlig leverskada med kliniska symtom och/eller hyperbilirubinemi eller gulsot inträffar under behandling med CRESTOR 20 mg, avbryt behandlingen omedelbart. Om en alternativ etiologi inte hittas, starta inte om CRESTOR.
CRESTOR 5mg ska användas med försiktighet till patienter som konsumerar betydande mängder alkohol och/eller har en historia av kronisk leversjukdom [se KLINISK FARMAKOLOGI ]. Aktiv leversjukdom, som kan innefatta oförklarliga ihållande transaminashöjningar, är en kontraindikation för användning av CRESTOR [se KONTRAINDIKATIONER ].
Samtidigt kumarinantikoagulantia
Försiktighet bör iakttas när antikoagulantia ges i kombination med CRESTOR på grund av dess potentiering av effekten av antikoagulantia av kumarintyp för att förlänga protrombintiden/INR. Hos patienter som tar kumarinantikoagulantia och CRESTOR samtidigt, bör INR bestämmas innan CRESTOR 10 mg påbörjas och tillräckligt ofta under tidig behandling för att säkerställa att ingen signifikant förändring av INR inträffar [se LÄKEMEDELSINTERAKTIONER ].
Proteinuri och hematuri
CRESTORs kliniska studieprogram observerades teststickspositiv proteinuri och mikroskopisk hematuri bland CRESTOR-behandlade patienter. Dessa fynd var vanligare hos patienter som tog CRESTOR 40 mg, jämfört med lägre doser av CRESTOR 20 mg eller jämförande HMG-CoA-reduktashämmare, även om det i allmänhet var övergående och inte var associerat med försämrad njurfunktion. Även om den kliniska betydelsen av detta fynd är okänd, bör en dosreduktion övervägas för patienter som behandlas med CRESTOR med oförklarlig ihållande proteinuri och/eller hematuri under rutinmässig urinanalys.
Endokrina effekter
Ökning av HbA1c och fastande serumglukosnivåer har rapporterats med HMG-CoA-reduktashämmare, inklusive CRESTOR. Baserat på data från kliniska prövningar med CRESTOR, kan dessa ökningar i vissa fall överstiga tröskeln för diagnos av diabetes mellitus [se NEGATIVA REAKTIONER ].
Även om kliniska studier har visat att CRESTOR 10 mg ensamt inte minskar den basala plasmakortisolkoncentrationen eller försämrar binjurarnas reserv, bör försiktighet iakttas om CRESTOR administreras samtidigt med läkemedel som kan minska nivåerna eller aktiviteten av endogena steroidhormoner såsom ketokonazol, spironolakton och cimetidin.
Information om patientrådgivning
Rekommendera patienten att läsa den FDA-godkända patientmärkningen ( PATIENTINFORMATION ).
Patienterna ska instrueras att inte ta 2 doser CRESTOR inom 12 timmar efter varandra.
Skelettmuskeleffekter
Patienter bör rådas att omedelbart rapportera oförklarlig muskelsmärta, ömhet eller svaghet, särskilt om de åtföljs av sjukdomskänsla eller feber eller om dessa muskeltecken eller symtom kvarstår efter att behandlingen med CRESTOR avbrutits.
Samtidig användning av antacida
När du tar CRESTOR 5 mg tillsammans med ett antacidum av aluminium och magnesiumhydroxid, ska antacidumet tas minst 2 timmar efter administrering av CRESTOR 10 mg.
Embryofetal toxicitet
Informera kvinnor om reproduktionspotential om risken för ett foster, att använda effektiva preventivmedel under behandlingen och att informera sin vårdgivare om en känd eller misstänkt graviditet. [ser KONTRAINDIKATIONER och Användning i specifika populationer ].
Laktation
Avråda kvinnor att inte amma under behandling med CRESTOR [se KONTRAINDIKATIONER och Användning i specifika populationer ].
Leverenzymer
Det rekommenderas att leverenzymetester utförs innan behandling med CRESTOR påbörjas och om tecken eller symtom på leverskada uppstår. Alla patienter som behandlas med CRESTOR bör rådas att omedelbart rapportera alla symtom som kan tyda på leverskada, inklusive trötthet, anorexi, obehag i övre högra delen av buken, mörk urin eller gulsot.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
I en 104-veckors karcinogenicitetsstudie på råttor vid dosnivåer på 2, 20, 60 eller 80 mg/kg/dag genom oral sondmatning, ökade incidensen av uterina stromala polyper signifikant hos honor vid 80 mg/kg/dag vid systemisk exponering 20 gånger den mänskliga exponeringen vid 40 mg/dag baserat på AUC. Ökad incidens av polyper sågs inte vid lägre doser.
en 107-veckors karcinogenicitetsstudie på möss som fick 10, 60 eller 200 mg/kg/dag genom oral sondmatning, observerades en ökad förekomst av hepatocellulärt adenom/karcinom vid 200 mg/kg/dag vid systemisk exponering 20 gånger den mänskliga exponeringen vid 40 mg/dag baserat på AUC. En ökad förekomst av hepatocellulära tumörer sågs inte vid lägre doser.
Rosuvastatin var inte mutagent eller klastogent med eller utan metabol aktivering i Ames-testet med Salmonella typhimurium och Escherichia coli, muslymfomanalysen och kromosomavvikelseanalysen i lungceller från kinesisk hamster. Rosuvastatin var negativt i mikrokärntestet in vivo på mus.
fertilitetsstudier på råtta med orala sondmatningsdoser på 5, 15, 50 mg/kg/dag, behandlades hanar i 9 veckor före och under parning och honor behandlades 2 veckor före parning och under hela parningen fram till dräktighetsdag 7. Inga negativa effekter effekt på fertiliteten observerades vid 50 mg/kg/dag (systemisk exponering upp till 10 gånger den mänskliga exponeringen vid 40 mg/dag baserat på AUC). Hos testiklar hos hundar som behandlats med rosuvastatin med 30 mg/kg/dag under en månad sågs jätteceller från sperma. Jätteceller från sperma observerades hos apor efter 6 månaders behandling med 30 mg/kg/dag utöver vakuolering av tubulärt seminiferös epitel. Exponeringen hos hunden var 20 gånger och hos apan 10 gånger den mänskliga exponeringen vid 40 mg/dag baserat på kroppsyta. Liknande fynd har setts med andra droger i denna klass.
Användning i specifika populationer
Graviditet
Risksammanfattning
CRESTOR 5 mg är kontraindicerat för användning till gravida kvinnor eftersom säkerheten hos gravida kvinnor inte har fastställts och det inte finns någon uppenbar fördel med behandling med CRESTOR 20 mg under graviditet. Eftersom HMG-CoA-reduktashämmare minskar kolesterolsyntesen och möjligen syntesen av andra biologiskt aktiva substanser som härrör från kolesterol, kan CRESTOR orsaka fosterskada när det administreras till gravida kvinnor. CRESTOR 5mg ska avbrytas så snart graviditet har upptäckts [se KONTRAINDIKATIONER ]. Begränsade publicerade data om användning av rosuvastatin är otillräckliga för att fastställa en läkemedelsrelaterad risk för allvarliga medfödda missbildningar eller missfall. I reproduktionsstudier på djur förekom inga negativa utvecklingseffekter vid oral administrering av rosuvastatin under organogenes vid systemisk exponering motsvarande en maximal rekommenderad humandos (MRHD) på 40 mg/dag hos råttor eller kaniner (baserat på AUC respektive kroppsytarea). ). Hos råttor och kaniner inträffade minskad överlevnad av valp/foster vid 12 gånger respektive motsvarande MRHD på 40 mg/dag [se Data ].
Den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall för den indikerade populationen är okänd. I den allmänna befolkningen i USA är den uppskattade bakgrundsrisken för stora fosterskador och missfall i kliniskt erkända graviditeter 2-4% respektive 15-20%.
Data
Mänskliga data
Begränsade publicerade data om rosuvastatin har inte visat någon ökad risk för allvarliga medfödda missbildningar eller missfall. Sällsynta rapporter om medfödda anomalier har mottagits efter intrauterin exponering för andra statiner. I en granskning av cirka 100 prospektivt följda graviditeter hos kvinnor som exponerats för simvastatin eller lovastatin översteg inte förekomsten av medfödda anomalier, spontana aborter och fosterdöd/dödfödsel vad som kunde förväntas i den allmänna befolkningen. Antalet fall är tillräckligt för att utesluta en ≥3 till 4-faldig ökning av medfödda anomalier jämfört med bakgrundsincidensen. I 89 % av de graviditeter som följts framåt, påbörjades läkemedelsbehandling före graviditeten och avbröts någon gång under första trimestern när graviditeten upptäcktes.
Djurdata
Rosuvastatin passerar placentan hos råttor och kaniner och återfinns i fostervävnad och fostervatten vid 3 % respektive 20 % av moderns plasmakoncentration efter en engångsdos på 25 mg/kg oral sondmatning på dräktighetsdag 16 hos råttor. En högre fostervävnadsfördelning (25 % maternell plasmakoncentration) observerades hos kaniner efter en enda oral sondmatningsdos på 1 mg/kg på dräktighetsdag 18.
Administrering av rosuvastatin indikerade ingen teratogen effekt hos råttor vid ≤25 mg/kg/dag eller hos kaniner ≤3 mg/kg/dag (doser motsvarande MRHD på 40 mg/dag baserat på AUC respektive kroppsyta).
Hos honråttor som gavs 5, 15 och 50 mg/kg/dag före parning och fortsatte till dräktighetsdag 7 resulterade i minskad fosterkroppsvikt (honungar) och försenad förbening vid 50 mg/kg/dag (10 gånger den mänskliga exponeringen vid MRHD-dosen på 40 mg/dag baserat på AUC).
Hos dräktiga råttor som fick 2, 10 och 50 mg/kg/dag av rosuvastatin från dräktighetsdag 7 till och med laktationsdag 21 (avvänjning) inträffade en minskad överlevnad av valpar vid 50 mg/kg/dag (dos motsvarande 12 gånger MRHD på 40 mg /dag baserad kroppsyta).
Hos dräktiga kaniner som fick 0,3, 1 och 3 mg/kg/dag av rosuvastatin från dräktighetsdag 6 till dag 18, observerades minskad fosterlivsduglighet och mödradödlighet vid 3 mg/kg/dag (dos motsvarande MRHD på 40 mg/dag dag baserat på kroppsyta).
Laktation
Risksammanfattning
Användning av rosuvastatin är kontraindicerat under amning [se KONTRAINDIKATIONER ]. Begränsade data indikerar att CRESTOR finns i bröstmjölk. Det finns ingen tillgänglig information om läkemedlets effekter på det ammade barnet eller läkemedlets effekter på mjölkproduktionen. På grund av risken för allvarliga biverkningar hos ett ammat spädbarn, informera patienterna om att amning inte rekommenderas under behandling med CRESTOR.
Kvinnor Och Hanar Av Reproduktionspotential
Preventivmedel
CRESTOR kan orsaka fosterskador när det administreras till en gravid kvinna [se Användning i specifika populationer ]. Rådgör kvinnor med reproduktionspotential att använda effektiva preventivmedel under behandling med CRESTOR.
Pediatrisk användning
Hos barn och ungdomar i åldern 8 till 17 år med heterozygot familjär hyperkolesterolemi, säkerheten och effektiviteten av CRESTOR 10 mg som tillägg till diet för att minska totalkolesterol, LDL-C och ApoB-nivåer när, efter en adekvat prövning av dietbehandling, LDL -C överstiger 190 mg/dL eller när LDL-C överstiger 160 mg/dL och det finns en positiv familjehistoria med prematur hjärt-kärlsjukdom eller två eller flera andra CVD-riskfaktorer, fastställdes i en kontrollerad studie och i en öppen, okontrollerad rättegång [se Kliniska studier ]. Långtidseffekten av CRESTOR-behandling som inleddes i barndomen för att minska sjuklighet och mortalitet i vuxen ålder har inte fastställts.
Säkerheten och effektiviteten av CRESTOR 5 mg hos barn och ungdomar 10 till 17 år med heterozygot familjär hyperkolesterolemi utvärderades i en kontrollerad klinisk prövning på 12 veckor följt av 40 veckors öppen exponering. Patienter som behandlades med 5 mg, 10 mg och 20 mg dagligen CRESTOR 10 mg hade en biverkningsprofil som i allmänhet liknade den för patienter som behandlades med placebo. Det fanns ingen detekterbar effekt av CRESTOR på tillväxt, vikt, BMI (body mass index) eller sexuell mognad [se Kliniska studier ] hos barn och ungdomar (10 till 17 år).
CRESTOR har inte studerats i kontrollerade kliniska prövningar med prepubertala patienter eller patienter yngre än 10 år med heterozygot familjär hyperkolesterolemi. Säkerheten och effektiviteten av CRESTOR utvärderades dock i en tvåårig öppen okontrollerad studie som inkluderade barn och ungdomar i åldern 8 till 17 år med heterozygot familjär hyperkolesterolemi [se Kliniska studier ]. Säkerheten och effekten av CRESTOR 5 mg för att sänka LDL-C verkade generellt överensstämma med den som observerats för vuxna patienter, trots begränsningar av den okontrollerade studiedesignen.
Barn och ungdomar 7 till 15 år med homozygot familjär hyperkolesterolemi studerades i en 6-veckors randomiserad, placebokontrollerad, cross-over-studie med CRESTOR 20 mg en gång dagligen följt av 12 veckors öppen behandling [se Kliniska studier ]. I allmänhet överensstämde säkerhetsprofilen i denna studie med den för den tidigare etablerade säkerhetsprofilen hos vuxna.
Även om inte alla biverkningar som identifierats i den vuxna befolkningen har observerats i kliniska prövningar av barn och ungdomar, bör samma varningar och försiktighetsåtgärder för vuxna övervägas för barn och ungdomar. Tonåriga kvinnor bör rådas om lämpliga preventivmetoder under behandling med CRESTOR 5 mg [se Användning i specifika populationer ].
Geriatrisk användning
Av de 10 275 patienterna i kliniska studier med CRESTOR var 3159 (31 %) 65 år och äldre och 698 (6,8 %) var 75 år och äldre. Inga övergripande skillnader i säkerhet eller effektivitet observerades mellan dessa försökspersoner och yngre försökspersoner, och annan rapporterad klinisk erfarenhet har inte identifierat skillnader i svar mellan äldre och yngre patienter, men större känslighet hos vissa äldre individer kan inte uteslutas.
Äldre patienter löper högre risk för myopati och CRESTOR bör förskrivas med försiktighet till äldre [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och KLINISK FARMAKOLOGI ].
Nedsatt njurfunktion
Rosuvastatinexponering påverkas inte av lätt till måttligt nedsatt njurfunktion (CLcr ≥30 ml/min/1,73 m²). Exponeringen för rosuvastatin ökar i kliniskt signifikant utsträckning hos patienter med gravt nedsatt njurfunktion (CLcr DOSERING OCH ADMINISTRERING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och KLINISK FARMAKOLOGI ].
Nedsatt leverfunktion
CRESTOR är kontraindicerat hos patienter med aktiv leversjukdom, vilket kan inkludera oförklarliga ihållande förhöjningar av levertransaminasnivåer. Kronisk alkoholleversjukdom är känd för att öka exponeringen för rosuvastatin; CRESTOR 20 mg ska användas med försiktighet till dessa patienter [se KONTRAINDIKATIONER , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och KLINISK FARMAKOLOGI ].
asiatiska patienter
Farmakokinetiska studier har visat en ungefärlig 2-faldig ökning av medianexponeringen för rosuvastatin hos asiatiska försökspersoner jämfört med kaukasiska kontroller. CRESTOR-dosen ska justeras till asiatiska patienter [se DOSERING OCH ADMINISTRERING och KLINISK FARMAKOLOGI ].
ÖVERDOS
Det finns ingen specifik behandling vid överdosering. I händelse av överdosering ska patienten behandlas symtomatiskt och stödjande åtgärder vidtas vid behov. Hemodialys ökar inte signifikant clearance av rosuvastatin.
KONTRAINDIKATIONER
CRESTOR 20 mg är kontraindicerat under följande tillstånd:
- Patienter med känd överkänslighet mot någon komponent i denna produkt. Överkänslighetsreaktioner inklusive hudutslag, klåda, urtikaria och angioödem har rapporterats med CRESTOR [se NEGATIVA REAKTIONER ].
- Patienter med aktiv leversjukdom, som kan inkludera oförklarliga ihållande förhöjningar av levertransaminasnivåer [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Graviditet [se Användning i specifika populationer ].
- Laktation. Begränsade data indikerar att CRESTOR 20 mg finns i bröstmjölk. Eftersom statiner har potential för allvarliga biverkningar hos ammande spädbarn, bör kvinnor som behöver CRESTOR-behandling inte amma sina spädbarn [se Användning i specifika populationer ].
KLINISK FARMAKOLOGI
Handlingsmekanism
CRESTOR 10mg är en selektiv och kompetitiv hämmare av HMG-CoA-reduktas, det hastighetsbegränsande enzymet som omvandlar 3-hydroxi-3-metylglutarylkoenzym A till mevalonat, en prekursor för kolesterol. In vivo-studier på djur och in vitro-studier på odlade djur- och humanceller har visat att rosuvastatin har ett högt upptag i, och selektivitet för, verkan i levern, målorganet för kolesterolsänkning. I in vivo- och in vitro-studier har rosuvastatin sin lipidmodifierande effekt på två sätt. För det första ökar det antalet lever-LDL-receptorer på cellytan för att förbättra upptaget och katabolismen av LDL. För det andra hämmar rosuvastatin leversyntesen av VLDL, vilket minskar det totala antalet VLDL- och LDL-partiklar.
Farmakodynamik
CRESTOR 5 mg dosberoende minskar förhöjt LDL-kolesterol och minskar totalkolesterol och triglycerider och ökar HDL-kolesterol [se Kliniska studier ]. Ett terapeutiskt svar på CRESTOR 5 mg är uppenbart inom 1 vecka efter påbörjad behandling och 90 % av maximalt svar uppnås vanligtvis inom 2 veckor. Det maximala svaret uppnås vanligtvis efter 4 veckor och bibehålls efter det. Individualisering av läkemedelsdosering bör baseras på det terapeutiska svaret [se DOSERING OCH ADMINISTRERING ].
Farmakokinetik
Absorption
I kliniska farmakologiska studier på människa nåddes maximala plasmakoncentrationer av rosuvastatin 3 till 5 timmar efter oral dosering. Både Cmax och AUC ökade i ungefärlig proportion till CRESTOR 10 mg dos. Den absoluta biotillgängligheten för rosuvastatin är cirka 20 %.
Administrering av CRESTOR tillsammans med mat påverkade inte AUC för rosuvastatin.
AUC för rosuvastatin skiljer sig inte efter administrering av läkemedel på kvällen eller morgonen.
Distribution
Genomsnittlig distributionsvolym vid steady-state för rosuvastatin är cirka 134 liter. Rosuvastatin är till 88 % bundet till plasmaproteiner, främst albumin. Denna bindning är reversibel och oberoende av plasmakoncentrationer.
Eliminering
Rosuvastatin elimineras främst genom utsöndring i avföringen. Eliminationshalveringstiden för rosuvastatin är cirka 19 timmar.
Ämnesomsättning
Rosuvastatin metaboliseras inte i stor utsträckning; cirka 10 % av en radiomärkt dos återvinns som metabolit. Huvudmetaboliten är N-desmetyl rosuvastatin, som huvudsakligen bildas av cytokrom P450 \ 2C9, och in vitro-studier har visat att N-desmetyl rosuvastatin har ungefär en sjättedel till hälften av den HMG-CoA-reduktasinhiberande aktiviteten av modersubstansen. . Sammantaget står mer än 90 % av den aktiva plasma-HMG-CoA-reduktasinhiberande aktiviteten för av moderföreningen.
Exkretion
Efter oral administrering utsöndras rosuvastatin och dess metaboliter primärt i feces (90%). Efter en intravenös dos skedde cirka 28 % av hela kroppens clearance via njurarna och 72 % via levern.
Specifika populationer
Ras eller etniska grupper
En populationsfarmakokinetisk analys visade inga kliniskt relevanta skillnader i farmakokinetik bland kaukasiska, latinamerikanska och svarta eller afro-karibiska grupper. Farmakokinetiska studier, inklusive en utförd i USA, har dock visat en ungefärlig 2-faldig ökning av medianexponeringen (AUC och Cmax) hos asiatiska försökspersoner jämfört med en kaukasisk kontrollgrupp.
Manliga Och Kvinnliga Patienter
Det fanns inga skillnader i plasmakoncentrationer av rosuvastatin mellan män och kvinnor.
Pediatriska patienter
I en populationsfarmakokinetisk analys av två pediatriska studier som involverade patienter med heterozygot familjär hyperkolesterolemi i åldern 10 till 17 år respektive 8 till 17 år, verkade exponeringen för rosuvastatin vara jämförbar med eller lägre än exponeringen för rosuvastatin hos vuxna patienter.
Geriatriska patienter
Det fanns inga skillnader i plasmakoncentrationer av rosuvastatin mellan icke-äldre och äldre populationer (ålder ≥65 år).
Patienter med nedsatt njurfunktion
Lätt till måttligt nedsatt njurfunktion (CLcr ≥30 ml/min/1,73 m²) hade ingen inverkan på plasmakoncentrationerna av rosuvastatin. Plasmakoncentrationerna av rosuvastatin ökade dock i kliniskt signifikant utsträckning (ca 3-faldigt) hos patienter med gravt nedsatt njurfunktion (CLcr 80 ml/min/ 1,73 m²).
Hemodialys
Steady-state plasmakoncentrationer av rosuvastatin hos patienter i kronisk hemodialys var cirka 50 % högre jämfört med friska frivilliga försökspersoner med normal njurfunktion.
Patienter med nedsatt leverfunktion
Hos patienter med kronisk alkoholleversjukdom ökade plasmakoncentrationerna av rosuvastatin måttligt.
Hos patienter med Child-Pugh A-sjukdom ökade Cmax och AUC med 60 % respektive 5 % jämfört med patienter med normal leverfunktion. Hos patienter med Child-Pugh B-sjukdom ökade Cmax och AUC med 100 % respektive 21 % jämfört med patienter med normal leverfunktion.
Studier av läkemedelsinteraktioner
Rosuvastatins clearance är inte beroende av metabolism av cytokrom P450 3A4 i en kliniskt signifikant utsträckning.
Rosuvastatin är ett substrat för vissa transportörproteiner inklusive leverupptagstransportören organiskt anjontransporterande polyprotein 1B1 (OATP1B1) och effluxtransportörbröstcancerresistensprotein (BCRP). Samtidig administrering av CRESTOR 10 mg och läkemedel som hämmar dessa transportproteiner (t.ex. ciklosporin, vissa hiv-proteashämmare) kan resultera i ökade plasmakoncentrationer av rosuvastatin [se DOSERING OCH ADMINISTRERING och LÄKEMEDELSINTERAKTIONER ].
Farmakogenomik
Disponering av HMG-CoA-reduktashämmare, inklusive rosuvastatin, involverar OATP1B1 och andra transportproteiner. Högre plasmakoncentrationer av rosuvastatin har rapporterats hos mycket små grupper av patienter (n=3 till 5) som har två nedsatt funktionsalleler av genen som kodar för OATP1B1 (SLCO1B1 521T > C). Frekvensen av denna genotyp (dvs. SLCO1B1 521 C/C) är i allmänhet lägre än 5 % i de flesta ras/etniska grupper. Effekten av denna polymorfism på effekten och/eller säkerheten av rosuvastatin har inte klarlagts.
Djurtoxikologi och/eller farmakologi
Toxicitet i centrala nervsystemet
CNS-kärlskador, kännetecknade av perivaskulära blödningar, ödem och mononukleär cellinfiltration av perivaskulära utrymmen, har observerats hos hundar som behandlats med flera andra medlemmar av denna läkemedelsklass. Ett kemiskt liknande läkemedel i denna klass producerade dosberoende degeneration av synnerven (Wallerian degeneration av retinogene fibrer) hos hundar, vid en dos som gav plasmaläkemedelsnivåer cirka 30 gånger högre än den genomsnittliga läkemedelsnivån hos människor som tog den högsta rekommenderade dosen. Ödem, blödning och partiell nekros i interstitium i plexus åderhinna observerades hos en honhund som offrades döende dag 24 vid 90 mg/kg/dag genom oral sondmatning (systemisk exponering 100 gånger den mänskliga exponeringen vid 40 mg/dag baserat på AUC). Korneal opacitet sågs hos hundar som behandlats i 52 veckor med 6 mg/kg/dag genom oral sondmatning (systemisk exponering 20 gånger den mänskliga exponeringen vid 40 mg/dag baserat på AUC). Katarakt sågs hos hundar som behandlats i 12 veckor med oral sondmatning vid 30 mg/kg/dag (systemisk exponering 60 gånger den mänskliga exponeringen vid 40 mg/dag baserat på AUC). Retinal dysplasi och retinal förlust sågs hos hundar som behandlats i 4 veckor med oral sondmatning vid 90 mg/kg/dag (systemisk exponering 100 gånger den mänskliga exponeringen vid 40 mg/dag baserat på AUC). Doser ≤30 mg/kg/dag (systemisk exponering ≤60 gånger den mänskliga exponeringen vid 40 mg/dag baserat på AUC) visade inte retinala fynd under behandling i upp till ett år.
Juvenile Toxicology Study
I en juvenil studie, doserades råttor genom oral sondmatning med 10 eller 50 mg/kg/dag från avvänjning i 9 veckor före parning, under hela parningen och fram till dagen före obduktion för hanar eller upp till dräktighetsdag 7 för honor. Inga effekter på sexuell utveckling, utseende av testiklar och epididymal eller fertilitet observerades vid någon av dosnivåerna (2 gånger eller upp till 24 gånger den mänskliga exponeringen (AUC) vid den maximala pediatriska dosen på 20 mg/dag).
Kliniska studier
Hyperlipidemi och blandad dyslipidemi
CRESTOR 5mg minskar Total-C, LDL-C, ApoB, nonHDL-C och TG, och ökar HDL-C, hos vuxna patienter med hyperlipidemi och blandad dyslipidemi.
Dosvarierande studie
I en multicenter, dubbelblind, placebokontrollerad, dosvarierande studie på patienter med hyperlipidemi CRESTOR som gavs som en daglig dos under 6 veckor reducerade signifikant Total-C, LDL-C, nonHDL-C och ApoB över dosen intervall (tabell 6).
Aktivt kontrollerad studie
CRESTOR 5mg jämfördes med HMG-CoA-reduktashämmarna atorvastatin, simvastatin och pravastatin i en multicenter, öppen dosvarierande studie av 2240 patienter med hyperlipidemi eller blandad dyslipidemi. Efter randomisering behandlades patienterna i 6 veckor med en enstaka daglig dos av antingen CRESTOR 20 mg, atorvastatin, simvastatin eller pravastatin (Figur 1 och Tabell 7).
Figur 1: Procentuell LDL-C-förändring per dos av CRESTOR 20 mg, Atorvastatin, Simvastatin och Pravastatin vid vecka 6 hos patienter med hyperlipidemi eller blandad dyslipidemi 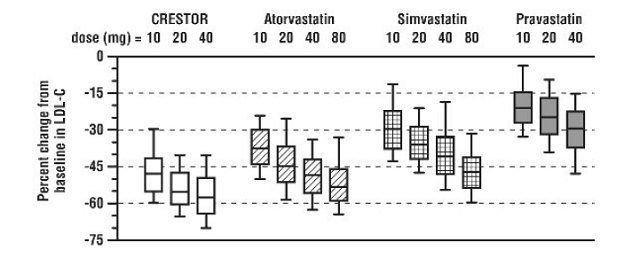
Boxplots är en representation av 25:e, 50:e och 75:e percentilvärdena, med morrhår som representerar 10:e och 90:e percentilvärdena. Genomsnittlig baslinje LDL-C: 189 mg/Dl
Heterozygot familjär hyperkolesterolemi
Aktivt kontrollerad studie
en studie av patienter med heterozygot FH (baslinjemedelvärde för LDL på 291) randomiserades patienterna till CRESTOR 20 mg eller atorvastatin 20 mg. Dosen ökades med 6 veckors intervall. Signifikanta minskningar av LDL-C från baslinjen sågs vid varje dos i båda behandlingsgrupperna (tabell 8).
Hypertriglyceridemi
Dos-respons-studie
I en dubbelblind, placebokontrollerad dos-respons-studie på patienter med baseline TG-nivåer från 273 till 817 mg/dL, reducerade CRESTOR 10 mg som engångsdos (5 till 40 mg) under 6 veckor signifikant serum TG-nivåer ( Tabell 9).
Primär dysbetalipoproteinemi (typ III hyperlipoproteinemi)
en randomiserad, multicenter, dubbelblind överkorsningsstudie gick 32 patienter (27 med ε2/ε2 och 4 med apo E-mutation [Arg145Cys] med primär dysbetalipoproteinemi (typ III hyperlipoproteinemi) in i en 6-veckors kosttillskottsperiod på NCEP Therapeutic Lifestyle Change (TLC) diet. Efter dietary introduktion randomiserades patienterna till en sekvens av behandlingar i samband med TLC-dieten under 6 veckor vardera: rosuvastatin 10 mg följt av rosuvastatin 20 mg eller rosuvastatin 20 mg följt av rosuvastatin 10 mg CRESTOR reducerade nivåerna av icke-HDL-C (primär slutpunkt) och cirkulerande kvarvarande lipoproteinnivåer. Resultaten visas i tabellen nedan.
Homozygot familjär hyperkolesterolemi
Dos-titreringsstudie
en öppen, påtvingad titreringsstudie utvärderades homozygota FH-patienter (n=40, 8-63 år) med avseende på deras svar på CRESTOR 20 till 40 mg titrerat med ett 6-veckorsintervall. I den totala populationen var den genomsnittliga minskningen av LDL-C från baslinjen 22 %. Ungefär en tredjedel av patienterna gynnades av att öka sin dos från 20 mg till 40 mg med ytterligare LDL-sänkning på mer än 6 %. Hos de 27 patienterna med minst 15 % minskning av LDL-C var den genomsnittliga minskningen av LDL-C 30 % (medianreduktion på 28 %). Bland 13 patienter med en LDL-C-reduktion på
Pediatriska patienter med homozygot familjär hyperkolesterolemi
CRESTOR studerades i en randomiserad, dubbelblind, placebokontrollerad, multicenter, crossover-studie på 14 barn och ungdomar med homozygot familjär hyperkolesterolemi. Studien inkluderade en 4-veckors inledningsfas i kosten under vilken patienterna fick CRESTOR 10 mg dagligen, en övergångsfas som inkluderade två 6-veckors behandlingsperioder med antingen CRESTOR 20 mg eller placebo i slumpmässig ordning, följt av en 12-veckors behandlingsperiod. vecka öppen fas under vilken alla patienter fick CRESTOR 20 mg. Patienterna varierade i ålder från 7 till 15 år (median 11 år), 50 % var män, 71 % var kaukasiska, 21 % var asiatiska, 7 % var svarta och inga patienter var av latinamerikansk etnicitet. Femtio procent fick aferesbehandling och 57 procent tog ezetimib. Patienter som ingick i studien med aferesbehandling eller ezetimib fortsatte behandlingen under hela studien. Medelvärdet för LDL-C vid baslinjen var 416 mg/dL (intervall 152 till 716 mg/dL). Totalt 13 patienter fullföljde båda behandlingsperioderna av den randomiserade övergångsfasen; en patient drog tillbaka samtycke på grund av oförmåga att få blod uttaget under överkorsningsfasen.
CRESTOR 20 mg reducerade signifikant LDL-C, totalkolesterol, ApoB och icke-HDL-C jämfört med placebo (tabell 11).
Pediatriska patienter med heterozygot familjär hyperkolesterolemi
I en dubbelblind, randomiserad, multicenter, placebokontrollerad, 12-veckorsstudie randomiserades 176 (97 män och 79 kvinnor) barn och ungdomar med heterozygot familjär hyperkolesterolemi till rosuvastatin 5, 10 eller 20 mg eller placebo dagligen. Patienterna varierade i ålder från 10 till 17 år (medianåldern 14 år) med cirka 30 % av patienterna 10 till 13 år och cirka 17 %, 18 %, 40 % och 25 % i Tanner-stadierna II, III, IV, och V, respektive. Kvinnorna var minst 1 år efter menarche. Medelvärdet för LDL-C vid baslinjen var 233 mg/dL (intervall från 129 till 399). Den 12 veckor långa dubbelblinda fasen följdes av en 40 veckors öppen dostitreringsfas, där alla patienter (n=173) fick 5 mg, 10 mg eller 20 mg rosuvastatin dagligen.
Rosuvastatin minskade signifikant LDL-C (primär slutpunkt), totalkolesterol och ApoB-nivåer vid varje dos jämfört med placebo. Resultaten visas i Tabell 12 nedan.
I slutet av den 12 veckor långa dubbelblinda behandlingsperioden var andelen patienter som uppnådde LDL-C-målet på mindre än 110 mg/dL (2,8 mmol/L) 0 % för placebo, 12 % för rosuvastatin 5 mg , 41 % för rosuvastatin 10 mg och 41 % för rosuvastatin 20 mg. Under den 40-veckors öppna fasen titrerades 71 % av patienterna till den maximala dosen på 20 mg och 41 % av patienterna uppnådde LDL-C-målet på 110 mg/dL.
Rosuvastatin studerades också i en tvåårig öppen, okontrollerad titrering till målstudie som inkluderade 175 barn och ungdomar med heterozygot familjär hyperkolesterolemi som var 8 till 17 år gamla (79 pojkar och 96 flickor). Alla patienter hade en dokumenterad genetisk defekt i LDL-receptorn eller i ApoB. Ungefär 89 % var kaukasiska, 7 % var asiatiska, 1 % var svarta och färre än 1 % var latinamerikanska. Medelvärdet för LDL-C vid baslinjen var 236 mg/dL. Femtioåtta (33%) patienter var prepubertala vid baslinjen. Startdosen för rosuvastatin för alla barn och ungdomar var 5 mg en gång dagligen. Barn 8 till mindre än 10 år (n=41 vid utgångsläget) kunde titrera till en maximal dos på 10 mg en gång dagligen, och barn och ungdomar 10 till 17 år kan titrera till en maximal dos på 20 mg en gång dagligen.
Minskningarna av LDL-C från baslinjen var generellt konsekventa över alla åldersgrupper inom studien såväl som med tidigare erfarenhet av både vuxna och pediatriskt kontrollerade studier.
Långtidseffekten av rosuvastatinbehandling inledd i barndomen för att minska sjuklighet och mortalitet i vuxen ålder har inte fastställts.
Bromsning av utvecklingen av åderförkalkning
studien Measuring Effects on Intima Media Thickness: an Evaluation Of Rosuvastatin 40 mg (METEOR)-studien utvärderades effekten av behandling med CRESTOR på karotis ateroskleros med B-mode ultraljud hos patienter med förhöjd LDL-C, med låg risk (Framingham-risk)
Den årliga förändringstakten från baslinjen för placebogruppen var +0,0131 mm/år (p
På individuell patientnivå i gruppen som behandlades med CRESTOR visade 52,1 % av patienterna frånvaro av sjukdomsprogression (definierad som en negativ årlig förändringshastighet), jämfört med 37,7 % av patienterna i placebogruppen.
Primärt förebyggande av kardiovaskulära sjukdomar
Justification for the Use of Statins in Primary Prevention: An Intervention Trial Evaluating Rosuvastatin (JUPITER) studie, utvärderades effekten av CRESTOR (rosuvastatinkalcium) på förekomsten av allvarliga kardiovaskulära (CV) sjukdomshändelser hos 17 802 män (≥50 år) ) och kvinnor (≥ 60 år) som inte hade någon kliniskt påvisad kardiovaskulär sjukdom, LDL-C-nivåer
Den primära slutpunkten var en sammansatt slutpunkt som bestod av tiden till första förekomsten av någon av följande större CV-händelser: CV-död, icke-fatal hjärtinfarkt, icke-fatal stroke, sjukhusvistelse för instabil angina eller en arteriell revaskulariseringsprocedur.
Rosuvastatin minskade signifikant risken för större CV-händelser (252 händelser i placebogruppen mot 142 händelser i rosuvastatingruppen) med en statistiskt signifikant (p
Figur 2: Tid till första förekomsten av större kardiovaskulära händelser i JUPITER 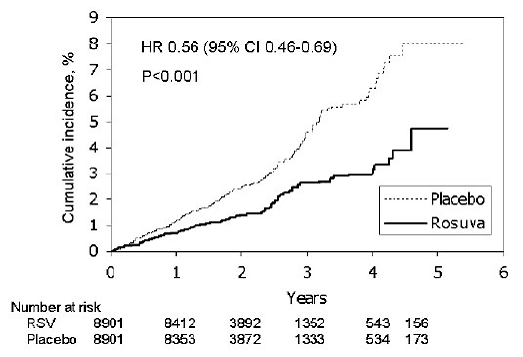
De individuella komponenterna i den primära slutpunkten presenteras i figur 3. Rosuvastatin minskade signifikant risken för icke-fatal hjärtinfarkt, icke-dödlig stroke och arteriell revaskularisering. Det fanns inga signifikanta behandlingsskillnader mellan rosuvastatin- och placebogruppen för dödsfall på grund av kardiovaskulära orsaker eller sjukhusvistelser för instabil angina.
Rosuvastatin minskade signifikant risken för hjärtinfarkt (6 fatala händelser och 62 icke-dödliga händelser hos placebobehandlade patienter jämfört med 9 fatala händelser och 22 icke-dödliga händelser hos rosuvastatinbehandlade patienter) och risken för stroke (6 fatala händelser och 58 icke-dödliga händelser i placebobehandlade försökspersoner mot 3 dödliga händelser och 30 icke-dödliga händelser hos rosuvastatinbehandlade försökspersoner).
en post-hoc subgruppsanalys av JUPITER-personer (n=1405; rosuvastatin=725, placebo=680) med en hsCRP ≥2 mg/L och inga andra traditionella riskfaktorer (rökning, BP ≥140/90 eller tar blodtryckssänkande medel, låg HDL-C) förutom ålder, efter justering för högt HDL-C, fanns det ingen signifikant behandlingsfördel med rosuvastatinbehandling.
Figur 3: Större CV-händelser per behandlingsgrupp i JUPITER 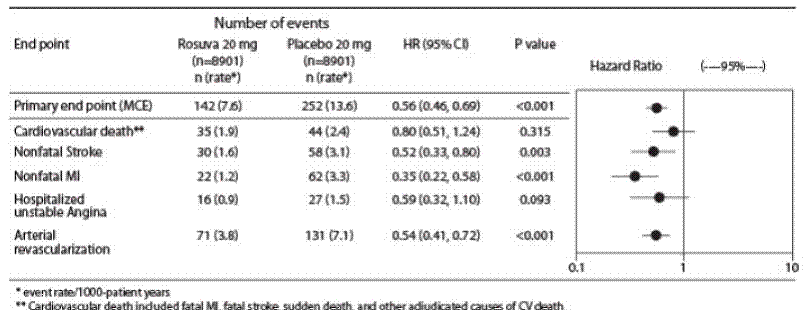
Efter ett år ökade rosuvastatin HDL-C och minskade LDL-C, hsCRP, totalkolesterol och serumtriglyceridnivåer (p
PATIENTINFORMATION
CRESTOR® (Kres-tor) rosuvastatin kalciumtabletter
Läs denna patientinformation noggrant innan du börjar ta CRESTOR 20 mg och varje gång du får påfyllning. Om du har några frågor om CRESTOR, fråga din läkare. Endast din läkare kan avgöra om CRESTOR är rätt för dig.
Vad är CRESTOR?
CRESTOR 20mg är ett receptbelagt läkemedel som innehåller ett kolesterolsänkande läkemedel som kallas rosuvastatinkalcium. Det mesta av kolesterolet i ditt blod görs i levern. CRESTOR 20mg verkar genom att sänka kolesterolet på två sätt: CRESTOR 5mg blockerar ett enzym i levern som gör att levern producerar mindre kolesterol, och CRESTOR 20mg ökar leverns upptag och nedbrytning av kolesterol som redan finns i blodet.
- CRESTOR används tillsammans med diet för att:
- sänk nivån av ditt "dåliga" kolesterol (LDL)
- öka nivån av ditt "goda" kolesterol (HDL)
- sänk nivån av fett i ditt blod (triglycerider)
- bromsa uppbyggnaden av fettavlagringar (plack) i blodkärlens väggar
- CRESTOR används för att behandla:
- vuxna som inte kan kontrollera sina kolesterolnivåer enbart med diet och träning
- barn 8 till 17 år med heterozygot familjär hyperkolesterolemi (ett ärftligt tillstånd som orsakar höga nivåer av LDL)
- barn 7 till 17 år med homozygot familjär hyperkolesterolemi (ett ärftligt tillstånd som orsakar höga nivåer av LDL).
CRESTOR 20mg är inte godkänt för användning hos barn med heterozygot familjär hyperkolesterolemi yngre än 8 år eller för användning hos barn med homozygot familjär hyperkolesterolemi yngre än 7 år.
CRESTOR 5mg används för att minska risken för hjärtinfarkt och stroke hos män 50 år och äldre och kvinnor 60 år och äldre som inte har känd hjärtsjukdom men som har vissa ytterligare riskfaktorer.
Det är inte känt om CRESTOR 10 mg är säkert och effektivt hos personer som har Fredrickson typ I och V dyslipidemier.
Vem ska inte ta CRESTOR?
Ta inte CRESTOR om du:
- är allergisk mot rosuvastatinkalcium eller något av innehållsämnena i CRESTOR. Se slutet av denna bipacksedel för en komplett lista över ingredienser i CRESTOR.
- har leverproblem.
- är gravid eller tror att du kan vara gravid, eller planerar att bli gravid. CRESTOR 20mg kan skada ditt ofödda barn. Om du blir gravid, sluta ta CRESTOR och kontakta din läkare omedelbart. Om du inte planerar att bli gravid bör du använda effektiv preventivmedel (preventivmedel) medan du tar CRESTOR.
- ammar. Läkemedel som CRESTOR 5 mg kan passera över i din bröstmjölk och kan skada ditt barn.
Vad ska jag berätta för min läkare innan och medan jag tar CRESTOR?
Tala om för din läkare om du:
- har oförklarlig muskelvärk eller svaghet
- har eller har haft njurproblem
- har eller har haft leverproblem
- drick mer än 2 glas alkohol dagligen
- har problem med sköldkörteln
- är 65 år eller äldre
- är av asiatisk härkomst
- är gravid eller tror att du kan vara gravid, eller planerar att bli gravid
- ammar
Berätta för din läkare om alla mediciner du tar, inklusive receptbelagda och receptfria läkemedel, vitaminer och växtbaserade kosttillskott.
Tala med din läkare innan du börjar ta några nya läkemedel.
Att ta CRESTOR 20 mg tillsammans med vissa andra läkemedel kan påverka varandra och orsaka biverkningar. CRESTOR kan påverka hur andra läkemedel fungerar och andra läkemedel kan påverka hur CRESTOR verkar.
Tala särskilt om för din läkare om du tar:
- ciklosporin (ett läkemedel för ditt immunförsvar)
- gemfibrozil (ett fibrinsyraläkemedel för att sänka kolesterolet)
- antivirala läkemedel inklusive hiv- eller hepatit C-proteashämmare (såsom lopinavir, ritonavir, fosamprenavir, tipranavir, atazanavir eller simeprevir)
- vissa läkemedel mot svamp (som itrakonazol, ketokonazol och flukonazol)
- kumarinantikoagulantia (läkemedel som förhindrar blodproppar, såsom warfarin)
- niacin eller nikotinsyra
- fibrinsyraderivat (som fenofibrat)
- kolchicin (ett läkemedel som används för att behandla gikt)
Fråga din läkare eller apotekspersonal om en lista över dessa läkemedel om du är osäker.
Känn till alla mediciner du tar. Håll en lista över dem för att visa din läkare och apotekspersonal när du får ny medicin.
Hur ska jag ta CRESTOR 10mg?
- Ta CRESTOR exakt som din läkare säger åt dig att ta det.
- Ta CRESTOR genom munnen 1 gång varje dag. Svälj tabletten hel.
- CRESTOR kan tas när som helst på dagen, med eller utan mat.
- Låt bli ändra din dos eller sluta med CRESTOR 10 mg utan att prata med din läkare, även om du mår bra.
- Din läkare kan ta blodprover för att kontrollera dina kolesterolnivåer före och under din behandling med CRESTOR. Din läkare kan ändra din dos av CRESTOR 10 mg om det behövs.
- Din läkare kan börja med en kolesterolsänkande diet innan du ger dig CRESTOR. Fortsätt med denna diet när du tar CRESTOR.
- Vänta minst 2 timmar efter att du tagit CRESTOR med att ta ett antacidum som innehåller en kombination av aluminium och magnesiumhydroxid.
- Om du missar en dos av CRESTOR 10 mg, ta den så snart du kommer ihåg det. I alla fall, ta inte 2 doser av CRESTOR 10 mg inom 12 timmar efter varandra.
- Om du tar för mycket CRESTOR 20 mg eller överdos, ring din läkare eller gå till närmaste akutmottagning direkt.
Vilka är de möjliga biverkningarna av CRESTOR 20mg?
CRESTOR 10mg kan orsaka allvarliga biverkningar, inklusive:
- Muskelsmärta, ömhet och svaghet (myopati). Muskelproblem, inklusive muskelnedbrytning, kan vara allvarliga hos vissa människor och orsaka sällan njurskador som kan leda till döden. Tala genast om för din läkare om:
- du har oförklarlig muskelsmärta, ömhet eller svaghet, särskilt om du har feber eller känner dig tröttare än vanligt medan du tar CRESTOR.
- du har muskelproblem som inte försvinner även efter att din läkare har sagt till dig att sluta ta CRESTOR. Din läkare kan göra ytterligare tester för att diagnostisera orsaken till dina muskelproblem.
Dina chanser att få muskelproblem är högre om du:
- tar vissa andra läkemedel medan du tar CRESTOR
- är 65 år eller äldre
- har sköldkörtelproblem (hypotyreos) som inte är kontrollerade
- har njurproblem
- tar högre doser av CRESTOR
- Leverproblem. Din läkare bör ta blodprov för att kontrollera din lever innan du börjar ta CRESTOR 5 mg och om du har symtom på leverproblem medan du tar CRESTOR. Ring din läkare omedelbart om du har något av följande symtom på leverproblem:
- känner sig ovanligt trött eller svag
- aptitlöshet
- smärta i övre delen av magen
- mörk urin
- gulfärgning av din hud eller det vita i dina ögon
De vanligaste biverkningarna kan vara: huvudvärk, muskelvärk och smärta, buksmärtor, svaghet och illamående.
Ytterligare biverkningar som har rapporterats med CRESTOR inkluderar minnesförlust och förvirring.
Tala om för din läkare om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av CRESTOR. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
Hur ska jag förvara CRESTOR 20mg?
- Förvara CRESTOR 10 mg i rumstemperatur, mellan 68°F till 77°F (20°C till 25°C) och på en torr plats.
- Kasta säkert medicin som är inaktuell eller inte längre behövs.
Förvara CRESTOR 10 mg och alla läkemedel utom räckhåll för barn.
Vilka är ingredienserna i CRESTOR?
Aktiv beståndsdel: rosuvastatin som rosuvastatinkalcium
Inaktiva Ingredienser: mikrokristallin cellulosa NF, laktosmonohydrat NF, tribasiskt kalciumfosfat NF, krospovidon NF, magnesiumstearat NF, hypromellos NF, triacetin NF, titandioxid USP, gul järnoxid och röd järnoxid NF.
Allmän information om säker och effektiv användning av CRESTOR
Läkemedel skrivs ibland ut för andra ändamål än de som anges i en patientinformationsbroschyr. Använd inte CRESTOR 10 mg för ett tillstånd som det inte har ordinerats för. Ge inte CRESTOR 20 mg till andra personer, även om de har samma medicinska tillstånd som du har. Det kan skada dem.
Du kan fråga din apotekspersonal eller läkare om information om CRESTOR 5mg som är skriven för vårdpersonal.
Denna patientinformation har godkänts av US Food and Drug Administration Reviderad 9/2018
