Lopid 300mg Gemfibrozil Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Lopid 300mg och hur används det?
Lopid (gemfibrozil) är ett lipidreglerande medel som används för att behandla mycket höga kolesterol- och triglyceridnivåer hos personer med pankreatit, och används också för att minska risken för stroke, hjärtinfarkt eller andra hjärtkomplikationer hos personer med högt kolesterol och triglycerider som har inte blivit hjälpt av andra behandlingar. Lopid finns i generisk form.
Vilka är biverkningarna av Lopid 300mg?
Vanliga biverkningar av Lopid 300mg inkluderar:
- magbesvär,
- ont i magen/buken,
- illamående,
- kräkningar,
- diarre,
- huvudvärk,
- yrsel,
- dåsighet,
- led- eller muskelvärk,
- förlorat intresse för sex,
- impotens,
- svårt att få orgasm,
- domningar eller stickningar,
- ovanlig smak, eller
- förkylningssymptom som täppt näsa, nysningar, ont i halsen.
Lopid 300mg kan sällan orsaka gallsten och leverproblem.
Tala om för din läkare om du märker någon av följande osannolika men allvarliga biverkningar av Lopid 300mg inklusive:
- svåra magsmärtor/buksmärtor,
- ihållande illamående eller kräkningar,
- gulnar ögon eller hud, och
- mörk urin.
BESKRIVNING
LOPID® (gemfibrozil tabletter, USP) är ett lipidreglerande medel. Det finns som tabletter för oral administrering. Varje tablett innehåller 600 mg gemfibrozil. Varje tablett innehåller även kalciumstearat, NF; candelillavax, FCC; mikrokristallin cellulosa, NF; hydroxipropylcellulosa, NF; hypromellos, USP; metylparaben, NF; Opaspray vit; polyetylenglykol, NF; polysorbat 80, NF; propylparaben, NF; kolloidal kiseldioxid, NF; förgelatinerad stärkelse, NF. Det kemiska namnet är 5-(2,5-dimetylfenoxi)-2,2-dimetylpentansyra, med följande strukturformel:
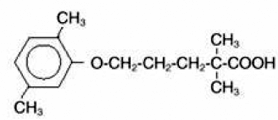
Den empiriska formeln är C15H22O3 och molekylvikten är 250,35; lösligheten i vatten och syra är 0,0019 % och i utspädd bas är den större än 1 %. Smältpunkten är 58° –61°C. Gemfibrozil är ett vitt fast ämne som är stabilt under vanliga förhållanden.
INDIKATIONER
LOPID (gemfibrozil tabletter, USP) är indicerat som tilläggsterapi till diet för:
en subgruppsanalys av patienter i Helsinki Heart Study med HDL-kolesterolvärden över medianvärdet vid baslinjen (större än 46,4 mg/dL), var incidensen av allvarliga kranskärlshändelser likartad för gemfibrozil och placebosubgrupper (se tabell I).
Den initiala behandlingen för dyslipidemi är dietterapi som är specifik för typen av lipoproteinavvikelse. Överdriven kroppsvikt och överskott av alkohol kan vara viktiga faktorer vid hypertriglyceridemi och bör hanteras före all läkemedelsbehandling. Fysisk träning kan vara en viktig hjälpåtgärd och har förknippats med höjningar av HDL-kolesterol. Sjukdomar som bidrar till hyperlipidemi såsom hypotyreos eller diabetes mellitus bör letas efter och behandlas adekvat. Östrogenterapi är ibland associerad med massiva ökningar av plasmatriglycerider, särskilt hos patienter med familjär hypertriglyceridemi. I sådana fall kan avbrytande av östrogenbehandling undanröja behovet av specifik läkemedelsbehandling av hypertriglyceridemi. Användning av läkemedel bör endast övervägas när rimliga försök har gjorts för att uppnå tillfredsställande resultat med icke-läkemedel. Om beslut fattas om att använda droger bör patienten informeras om att detta inte minskar vikten av att hålla sig till kosten.
DOSERING OCH ADMINISTRERING
Den rekommenderade dosen för vuxna är 1200 mg administrerat i två uppdelade doser 30 minuter före morgon- och kvällsmåltider (se KLINISK FARMAKOLOGI ).
HUR LEVERERAS
LOPID (Tablett 737), vita, elliptiska, filmdragerade, skårade tabletter, som var och en innehåller 600 mg gemfibrozil, finns tillgängliga enligt följande:
NDC 0071-0737-20: 60 flaskor NDC 0071-0737-30: 500 flaskor
Förvara i kontrollerad rumstemperatur 20° – 25°C (68° – 77°F) [se USP]. Skydda mot ljus och fukt.
Distribueras av Parke-Davis Division of Pfizer Inc, NY, NY 10017. Reviderad: Dec 2020
BIEFFEKTER
I den dubbelblinda kontrollerade fasen av den primära preventionskomponenten i Helsinki Heart Study fick 2046 patienter LOPID i upp till fem år. I den studien var följande biverkningar statistiskt vanligare hos försökspersoner i LOPID-gruppen:
Gallblåsoperation utfördes hos 0,9 % av LOPID 300 mg och 0,5 % av placebopatienterna i den primära förebyggande komponenten, ett överskott på 64 %, vilket inte är statistiskt skilt från överskottet av gallblåsoperationer som observerats i klofibratgruppen jämfört med placebogruppen i WHO-studien . Gallblåsoperation utfördes också oftare i LOPID-gruppen jämfört med placebogruppen (1,9 % mot 0,3 %, p=0,07) i den sekundära preventionskomponenten. En statistiskt signifikant ökning av blindtarmsoperation i gemfibrozilgruppen sågs även i den sekundära preventionskomponenten (6 på gemfibrozil mot 0 på placebo, p=0,014).
Biverkningar av nervsystemet och speciella sinnen var vanligare i gruppen LOPID 300 mg. Dessa inkluderade hypestesi, parestesier och smakperversion. Andra biverkningar som var vanligare bland patienter i behandlingsgruppen LOPID 300 mg men där ett orsakssamband inte kunde fastställas inkluderar grå starr, perifer vaskulär sjukdom och intracerebral blödning.
Från andra studier verkar det troligt att LOPID 300 mg är kausalt relaterat till förekomsten av MUSKULOSKELETTA SYMPTOM (se VARNINGAR ), och till ABNORMAL LEVERFUNKTIONSTESTER och HEMATOLOGISKA FÖRÄNDRINGAR (se FÖRSIKTIGHETSÅTGÄRDER ).
Rapporter om virala och bakteriella infektioner (vanlig förkylning, hosta, urinvägsinfektioner) var vanligare hos gemfibrozilbehandlade patienter i andra kontrollerade kliniska prövningar med 805 patienter. Ytterligare biverkningar som har rapporterats för gemfibrozil listas nedan per system. Dessa kategoriseras efter om ett orsakssamband till behandling med LOPID är sannolikt eller inte fastställt:
Ytterligare biverkningar som har rapporterats inkluderar kolecystit och kolelitiasis (ser VARNINGAR ).
LÄKEMEDELSINTERAKTIONER
HMG-CoA-reduktashämmare
Samtidig administrering av LOPID 300 mg och simvastatin är kontraindicerad (se KONTRAINDIKATIONER och VARNINGAR ). Undvik samtidig användning av LOPID och rosuvastatin. Om samtidig användning inte kan undvikas, påbörja rosuvastatin med 5 mg en gång dagligen. Dosen av rosuvastatin bör inte överstiga 10 mg en gång dagligen. Risken för myopati och rabdomyolys ökar vid kombinerad behandling med gemfibrozil och HMG-CoA-reduktashämmare. Myopati eller rabdomyolys med eller utan akut njursvikt har rapporterats så tidigt som tre veckor efter påbörjad kombinationsbehandling eller efter flera månader (se VARNINGAR ). Det finns ingen garanti för att periodisk övervakning av kreatinkinas kommer att förhindra uppkomsten av allvarlig myopati och njurskador.
Antikoagulantia
FÖRSIKTIGHET BÖR UTÖVAS NÄR WARFARIN GES I SAMBAND MED LOPID. DOSERINGEN AV WARFARIN BÖR MINSKAS FÖR ATT BEHÅLLA PROTHROMBINTIDEN PÅ ÖNSKAD NIVÅ FÖR ATT FÖRHINDRA BLÖDNINGSKOMPLIKATIONER. FREKVENTA PROTROMBINBESTÄMNINGAR ÄR LÄMLIGT TILL DET DEFINITIVT HAR BESTÄMTS ATT PROTROMBINNIVÅN HAR STABILISERATS.
CYP2C8 Substrat
Gemfibrozil är en stark hämmare av CYP2C8 och kan öka exponeringen av läkemedel som huvudsakligen metaboliseras av CYP2C8 (t.ex. dabrafenib, enzalutamid, loperamid, montelukast, paklitaxel, pioglitazon, rosiglitazon). Därför kan dosreduktion av läkemedel som huvudsakligen metaboliseras av CYP2C8-enzymet krävas när gemfibrozil används samtidigt (se VARNINGAR ).
Repaglinid
Hos friska frivilliga gav samtidig administrering med gemfibrozil (600 mg två gånger dagligen i 3 dagar) en 8,1-faldig (intervall 5,5- till 15,0-faldig) högre repaglinid-AUC och en 28,6-faldig (intervall 18,5- till 80,1-faldig) högre plasmakoncentration av repaglinid 7 timmar efter dosen. I samma studie resulterade gemfibrozil (600 mg två gånger dagligen i 3 dagar) + itrakonazol (200 mg på morgonen och 100 mg på kvällen på dag 1, sedan 100 mg två gånger dagligen på dag 2-3) i en 19,4-( intervall 12,9 till 24,7 gånger högre repaglinid AUC och en 70,4 gånger (intervall 42,9 till 119,2 gånger) högre plasmakoncentration av repaglinid 7 timmar efter dosen. Dessutom förlängde enbart gemfibrozil eller gemfibrozil + itrakonazol de hypoglykemiska effekterna av repaglinid. Samtidig administrering av gemfibrozil och repaglinid ökar risken för svår hypoglykemi och är kontraindicerat (se KONTRAINDIKATIONER ).
Dasabuvir
Samtidig administrering av gemfibrozil och dasabuvir ökade dasabuvirs AUC och Cmax (kvoter: 11,3 respektive 2,01) på grund av CYP2C8-hämning. Ökad dasabuvirexponering kan öka risken för QT-förlängning, därför är samtidig administrering av gemfibrozil och dasabuvir kontraindicerat (se KONTRAINDIKATIONER ).
Selexipag
Samtidig administrering av gemfibrozil och selexipag fördubblade exponeringen för selexipag och ökade exponeringen för den aktiva metaboliten med cirka 11 gånger. Samtidig administrering av gemfibrozil och selexipag är kontraindicerat (se KONTRAINDIKATIONER ).
Enzalutamid
Hos friska frivilliga som fick en engångsdos på 160 mg enzalutamid efter gemfibrozil 600 mg två gånger dagligen, ökade AUC för enzalutamid plus aktiv metabolit (N-desmetylenzalutamid) med 2,2 gånger och motsvarande Cmax minskade med 16 %. Ökad exponering för enzalutamid kan öka risken för anfall. Om samtidig administrering anses nödvändig bör dosen av enzalutamid minskas (se VARNINGAR ).
OATP1B1 substrat
Gemfibrozil är en hämmare av OATP1B1-transportör och kan öka exponeringen av läkemedel som är substrat för OATP1B1 (t.ex. atrasentan, atorvastatin, bosentan, ezetimib, fluvastatin, glyburid, SN-38 [aktiv metabolit av irinotecan], rosuvastatin, rifinavastatin, pravpitavastatin, valsartan, olmesartan). Därför kan dosreduktioner av läkemedel som är substrat för OATP1B1 krävas när gemfibrozil används samtidigt (se VARNINGAR ). Kombinationsbehandling av gemfibrozil med simvastatin eller med repaglinid, som är OATP1B1-substrat, är kontraindicerat (se KONTRAINDIKATIONER ).
In vitro-studier av CYP-enzymer, UGTA-enzymer och OATP1B1-transportörer
In vitro-studier har visat att gemfibrozil är en hämmare av CYP1A2, CYP2C8, CYP2C9, CYP2C19, OATP1B1 och UDP-glukuronosyltransferas (UGT) 1A1 och 1A3 (se VARNINGAR ).
Gallsyrabindande hartser
Gemfibrozil AUC minskade med 30 % när gemfibrozil gavs (600 mg) samtidigt med hartsgranulläkemedel såsom kolestipol (5 g). Administrering av läkemedlen med två timmars mellanrum eller mer rekommenderas eftersom exponeringen av gemfibrozil inte påverkades signifikant när den administrerades med två timmars mellanrum från kolestipol.
Kolchicin
Myopati, inklusive rabdomyolys, har rapporterats vid kronisk administrering av kolkicin i terapeutiska doser. Samtidig användning av LOPID kan potentiera utvecklingen av myopati. Patienter med nedsatt njurfunktion och äldre patienter löper ökad risk. Försiktighet bör iakttas vid förskrivning av LOPID med kolchicin, särskilt hos äldre patienter eller patienter med nedsatt njurfunktion.
VARNINGAR
På grund av den mer begränsade storleken på Helsinki Heart Study skiljer sig den observerade skillnaden i dödlighet oavsett orsak mellan LOPID 300 mg och placebogruppen inte statistiskt signifikant från de 29 % överdödlighet som rapporterades i klofibratgruppen i den separata WHO-studien vid nio års uppföljning (se KLINISK FARMAKOLOGI ). Icke-koronar hjärtsjukdom relaterad dödlighet visade ett överskott i gruppen som ursprungligen randomiserades till LOPID, främst på grund av cancerdödsfall som observerats under den öppna förlängningen.
Under den femåriga primärpreventionskomponenten i Helsinki Heart Study var dödligheten oavsett orsak 44 (2,2 %) i LOPID 300 mg-gruppen och 43 (2,1 %) i placebogruppen; inklusive den 3,5-åriga uppföljningsperioden sedan studien avslutades, var den kumulativa dödligheten oavsett orsak 101 (4,9 %) i LOPID-gruppen och 83 (4,1 %) i gruppen som ursprungligen randomiserades till placebo (riskkvot 1:20 till fördel av placebo). På grund av den mer begränsade storleken på Helsinki Heart Study skiljer sig den observerade skillnaden i dödlighet oavsett orsak mellan LOPID 300 mg och placebogruppen vid år 5 eller år 8,5 inte statistiskt signifikant från den 29 % överdödlighet som rapporterades i klofibratgruppen i den separata WHO-studien vid nioårsuppföljningen. Icke-koronar hjärtsjukdomsrelaterad dödlighet visade ett överskott i gruppen som ursprungligen randomiserades till LOPID 300 mg vid 8,5 års uppföljning (65 LOPID 300 mg kontra 45 placebo icke-koronära dödsfall).
Incidensen av cancer (exklusive basalcellscancer) som upptäcktes under prövningen och under de 3,5 åren efter att prövningen avslutades var 51 (2,5 %) i båda de ursprungligen randomiserade grupperna. Dessutom fanns det 16 basalcellscancer i gruppen som ursprungligen randomiserades till LOPID 300 mg och 9 i gruppen som ursprungligen randomiserades till placebo (p=0,22). Det fanns 30 (1,5 %) dödsfall tillskrivna cancer i gruppen som ursprungligen randomiserades till LOPID 300 mg och 18 (0,9 %) i gruppen som ursprungligen randomiserades till placebo (p=0,11). Biverkningar, inklusive kranskärlshändelser, var högre hos gemfibrozilpatienter i en motsvarande studie på män med en historia av känd eller misstänkt kranskärlssjukdom i den sekundära preventionskomponenten i Helsinki Heart Study (se KLINISK FARMAKOLOGI ).
En jämförande karcinogenicitetsstudie gjordes också på råttor som jämförde tre läkemedel i denna klass: fenofibrat (10 och 60 mg/kg; 0,3 respektive 1,6 gånger humandosen), klofibrat (400 mg/kg; 1,6 gånger humandosen), och gemfibrozil (250 mg/kg; 1,7 gånger humandosen). Pankreatiska acinära adenom ökade hos män och kvinnor på fenofibrat; hepatocellulära karcinom och pankreatiska acinära adenom ökade hos män och neoplastiska knölar i lever hos kvinnor behandlade med klofibrat; leverneoplastiska knölar ökade hos män och kvinnor som behandlats med klofibrat; neoplastiska knölar i levern ökade hos män och kvinnor som behandlats med gemfibrozil, medan testikulära interstitiell cell (Leydig-cell) tumörer ökade hos män på alla tre läkemedlen.
FÖRSIKTIGHETSÅTGÄRDER
Initial terapi
Laboratoriestudier bör göras för att säkerställa att lipidnivåerna genomgående är onormala. Innan LOPID-behandling påbörjas bör alla försök göras för att kontrollera serumlipider med lämplig diet, träning, viktminskning hos överviktiga patienter och kontroll av eventuella medicinska problem såsom diabetes mellitus och hypotyreos som bidrar till lipidavvikelserna.
Fortsatt terapi
Periodisk bestämning av serumlipider bör erhållas och läkemedlet sättas ut om lipidsvaret är otillräckligt efter tre månaders behandling.
Karcinogenes, Mutagenes, Nedsatt fertilitet
Långtidsstudier har utförts på råttor med 0,2 och 1,3 gånger den mänskliga exponeringen (baserat på AUC). Incidensen av godartade leverknölar och leverkarcinom ökade signifikant hos råttor av hankön med höga doser. Incidensen av leverkarcinom ökade även hos lågdoshanar, men denna ökning var inte statistiskt signifikant (p=0,1). Hanråttor hade en dosrelaterad och statistiskt signifikant ökning av benigna Leydigcelltumörer. Honråttorna med högre dos hade en signifikant ökning av den kombinerade förekomsten av benigna och maligna leverneoplasmer.
Långtidsstudier har utförts på möss med 0,1 och 0,7 gånger den mänskliga exponeringen (baserat på AUC). Det fanns inga statistiskt signifikanta skillnader från kontroller i förekomsten av levertumörer, men de testade doserna var lägre än de som visades vara cancerframkallande med andra fibrater.
Elektronmikroskopistudier har visat en florid leverperoxisomproliferation efter administrering av LOPID till hanråttan. En adekvat studie för att testa för peroxisomproliferation har inte gjorts på människor men förändringar i peroxisommorfologi har observerats. Peroxisomproliferation har visats förekomma hos människor med något av två andra läkemedel av fibratklassen när leverbiopsier jämfördes före och efter behandling hos samma individ.
Administrering av cirka 2 gånger den mänskliga dosen (baserat på ytarea) till hanråttor under 10 veckor resulterade i en dosrelaterad minskning av fertiliteten. Efterföljande studier visade att denna effekt vändes efter en läkemedelsfri period på cirka åtta veckor och att den inte överfördes till avkomman.
Graviditet
LOPID 300mg har visat sig ge biverkningar på råttor och kaniner vid doser mellan 0,5 och 3 gånger den mänskliga dosen (baserat på ytan). Det finns inga adekvata och välkontrollerade studier på gravida kvinnor. LOPID 300 mg ska endast användas under graviditet om den potentiella nyttan överväger den potentiella risken för fostret.
Administrering av LOPID 300 mg till honråttor vid 2 gånger den mänskliga dosen (baserat på ytan) före och under hela dräktigheten orsakade en dosrelaterad minskning av befruktningshastigheten, en ökning av dödfödda barn och en lätt minskning av valpvikten under laktation. Det fanns också dosrelaterade ökade skelettvariationer. Anoftalmi förekom, men sällan.
Administrering av 0,6 och 2 gånger den humana dosen (baserat på ytan) av LOPID till honråttor från dräktighetsdag 15 till och med avvänjning orsakade dosrelaterade minskningar av födelsevikt och hämning av valptillväxt under laktation.
Administrering av 1 och 3 gånger den humana dosen (baserat på ytan) av LOPID 300 mg till honkaniner under organogenesen orsakade en dosrelaterad minskning av kullstorleken och, vid den höga dosen, en ökad förekomst av parietalbensvariationer.
Ammande mödrar
Det är inte känt om detta läkemedel utsöndras i modersmjölk. Eftersom många läkemedel utsöndras i bröstmjölk och på grund av potentialen för tumörframkallande egenskaper som visat sig för LOPID i djurstudier, bör ett beslut fattas om att avbryta amningen eller att avbryta läkemedlet, med hänsyn till läkemedlets betydelse för modern.
Hematologiska förändringar
Mild minskning av hemoglobin, hematokrit och vita blodkroppar har observerats hos enstaka patienter efter påbörjad LOPID-behandling. Dessa nivåer stabiliseras dock under långtidsadministrering. I sällsynta fall har svår anemi, leukopeni, trombocytopeni och benmärgshypoplasi rapporterats.
Därför rekommenderas periodiska blodvärden under de första 12 månaderna av administrering av LOPID 300 mg.
Leverfunktion
Onormala leverfunktionstester har observerats ibland under administrering av LOPID, inklusive förhöjningar av ASAT, ALAT, LDH, bilirubin och alkaliskt fosfatas. Dessa är vanligtvis reversibla när LOPID 300 mg avbryts. Därför rekommenderas periodiska leverfunktionsstudier och behandling med LOPID 300 mg bör avbrytas om avvikelser kvarstår.
Njurfunktion
Det har förekommit rapporter om försämrad njurinsufficiens vid tillägg av LOPID-behandling hos individer med plasmakreatinin >2,0 mg/dl vid baseline. Hos sådana patienter bör användningen av alternativ behandling övervägas mot riskerna och fördelarna med en lägre dos av LOPID.
Pediatrisk användning
Säkerhet och effekt hos pediatriska patienter har inte fastställts.
ÖVERDOS
Det har rapporterats fall av överdosering med LOPID. I ett fall återhämtade sig ett 7-årigt barn efter att ha fått i sig upp till 9 gram LOPID. Symtom som rapporterats vid överdosering var magkramper, onormala leverfunktionstester, diarré, ökad CPK, led- och muskelvärk, illamående och kräkningar. Symtomatiska stödåtgärder bör vidtas om en överdos skulle inträffa.
KONTRAINDIKATIONER
KLINISK FARMAKOLOGI
LOPID är ett lipidreglerande medel som minskar serumtriglycerider och mycket lågdensitetslipoproteinkolesterol (VLDL) och ökar högdensitetslipoproteinkolesterol (HDL). Medan måttliga minskningar av totalt kolesterol och lågdensitetslipoprotein (LDL)-kolesterol kan observeras vid behandling med LOPID 300 mg, resulterar behandling av patienter med förhöjda triglycerider på grund av typ IV-hyperlipoproteinemi ofta i en ökning av LDL-kolesterol. LDL-kolesterolnivåer hos typ IIb-patienter med förhöjningar av både serum-LDL-kolesterol och triglycerider påverkas i allmänhet minimalt av behandling med LOPID 300 mg; dock höjer LOPID 300mg vanligtvis HDL-kolesterol signifikant i denna grupp. LOPID 300mg ökar nivåerna av högdensitetslipoprotein (HDL) subfraktioner HDL2 och HDL3, såväl som apolipoproteinerna AI och AII. Epidemiologiska studier har visat att både lågt HDL-kolesterol och högt LDL-kolesterol är oberoende riskfaktorer för kranskärlssjukdom.
den primära förebyggande komponenten i Helsinki Heart Study, där 4081 manliga patienter mellan 40 och 55 år studerades på ett randomiserat, dubbelblindt, placebokontrollerat sätt, var LOPID 300 mg-terapi associerad med signifikant minskning av totala plasmatriglycerider och en signifikant ökning av högdensitetslipoproteinkolesterol. Måttliga minskningar av totalt plasmakolesterol och lågdensitetslipoproteinkolesterol observerades för LOPID-behandlingsgruppen som helhet, men lipidsvaret var heterogent, särskilt bland olika Fredrickson-typer. Studien involverade personer med icke-HDL-kolesterol i serum på över 200 mg/dL och ingen tidigare historia av kranskärlssjukdom. Under den femåriga studieperioden upplevde LOPID 300 mg-gruppen en 1,4 % absolut (34 % relativ) minskning av frekvensen av allvarliga kranskärlshändelser (plötsliga hjärtdödsfall plus dödliga och icke-dödliga hjärtinfarkter) jämfört med placebo, p=0,04 (se Tabell I). Det var en 37 % relativ minskning av frekvensen av icke-dödlig hjärtinfarkt jämfört med placebo, vilket motsvarar en behandlingsrelaterad skillnad på 13,1 händelser per tusen personer. Dödsfall oavsett orsak under den dubbelblinda delen av studien uppgick till 44 (2,2 %) i LOPID 300 mg randomiseringsgruppen och 43 (2,1 %) i placebogruppen.
Bland Fredrickson-typerna, under den 5-åriga dubbelblinda delen av den primära preventionskomponenten i Helsinki Heart Study, inträffade den största minskningen av incidensen av allvarliga kranskärlshändelser hos patienter av typ IIb som hade förhöjningar av både LDL-kolesterol och total plasma. triglycerider. Denna undergrupp av patienter i typ IIb-gemfibrozilgruppen hade en lägre genomsnittlig HDL-kolesterolnivå vid baslinjen än typ IIa-undergruppen som hade förhöjda LDL-kolesterol och normala plasmatriglycerider. Den genomsnittliga ökningen av HDL-kolesterol bland typ IIb-patienterna i denna studie var 12,6 % jämfört med placebo. Den genomsnittliga förändringen av LDL-kolesterol bland patienter med typ IIb var –4,1 % med LOPID jämfört med en ökning med 3,9 % i placeboundergruppen. Typ IIb-personerna i Helsinki Heart Study hade 26 färre kranskärlshändelser per tusen personer under fem år i gemfibrozilgruppen jämfört med placebo. Skillnaden i kranskärlshändelser var avsevärt större mellan LOPID 300 mg och placebo för den undergruppen av patienter med triaden LDL-kolesterol >175 mg/dL (>4,5 mmol), triglycerider >200 mg/dL (>2,2 mmol) och HDL -kolesterol
Ytterligare information finns tillgänglig från en 3,5-årig (8,5 år kumulativ) uppföljning av alla försökspersoner som hade deltagit i Helsinki Heart Study. Vid slutförandet av Helsinki Heart Study kunde försökspersoner välja att börja, sluta eller fortsätta att få LOPID; utan kunskap om sina egna lipidvärden eller dubbelblind behandling började 60 % av patienterna som ursprungligen randomiserades till placebo behandling med LOPID 300 mg och 60 % av patienterna som ursprungligen randomiserades till LOPID fortsatte med medicinering. Efter cirka 6,5 år efter randomisering informerades alla patienter om sin ursprungliga behandlingsgrupp och lipidvärden under de fem åren av den dubbelblinda behandlingen. Efter ytterligare elektiva förändringar i LOPID-behandlingsstatus tog 61 % av patienterna i gruppen som ursprungligen randomiserades till LOPID läkemedel; i gruppen som ursprungligen randomiserades till placebo, tog 65 % LOPID. Händelsefrekvensen per 1000 som inträffar under den öppna uppföljningsperioden beskrivs i tabell II.
Kumulativ dödlighet under 8,5 år visade ett 20 % relativt överskott av dödsfall i gruppen som ursprungligen randomiserades till LOPID 300 mg jämfört med den ursprungligen randomiserade placebogruppen och en 20 % relativ minskning av hjärthändelser i gruppen som ursprungligen randomiserades till LOPID 300 mg jämfört med den ursprungligen randomiserade placebogruppen (se tabell III). Denna analys av den ursprungligen randomiserade "intent-to-treat"-populationen försummar de möjliga komplicerande effekterna av behandlingsbyte under den öppna fasen. Justering av riskkvoter, med hänsyn till öppen behandlingsstatus från år 6,5 till 8,5, kan ändra de rapporterade riskkvoterna för dödlighet mot enhet.
Det är inte klart i vilken utsträckning resultaten av den primära förebyggande komponenten i Helsinki Heart Study kan extrapoleras till andra segment av den dyslipidemiska populationen som inte studerats (som kvinnor, yngre eller äldre män, eller de med lipidavvikelser begränsade enbart till HDL -kolesterol) eller till andra lipidförändrande läkemedel.
Den sekundära preventionskomponenten i Helsinki Heart Study genomfördes under fem år parallellt och vid samma centra i Finland i 628 medelålders män som exkluderades från den primära preventionskomponenten i Helsinki Heart Study på grund av en historia av angina, hjärtinfarkt, eller oförklarliga EKG-förändringar. Studiens primära effektmått var hjärthändelser (summan av dödliga och icke-dödliga hjärtinfarkter och plötsliga hjärtdödsfall). Hazard ratio (LOPID:placebo) för hjärthändelser var 1,47 (95 % konfidensgränser 0,88–2,48, p=0,14). Av de 35 patienterna i LOPID 300 mg-gruppen som upplevde hjärthändelser drabbades 12 patienter av händelser efter att studien avbröts. Av de 24 patienterna i placebogruppen med hjärthändelser drabbades 4 patienter av händelser efter att studien avbröts. Det var 17 hjärtdödsfall i LOPID-gruppen och 8 i placebogruppen (hazard ratio 2,18; 95 % konfidensgränser 0,94–5,05, p=0,06). Tio av dessa dödsfall i LOPID-gruppen och 3 i placebogruppen inträffade efter avslutad behandling. I denna studie av patienter med känd eller misstänkt kranskärlssjukdom observerades ingen nytta av behandling med LOPID 300 mg för att minska hjärthändelser eller hjärtdödsfall. Således har LOPID 300 mg visat fördel endast hos utvalda dyslipidemiska patienter utan misstänkt eller etablerad kranskärlssjukdom. Även hos patienter med kranskärlssjukdom och triaden av förhöjt LDL-kolesterol, förhöjda triglycerider plus lågt HDL-kolesterol, har den möjliga effekten av LOPID på kranskärlshändelser inte studerats tillräckligt.
Ingen effekt hos patienter med etablerad kranskärlssjukdom observerades under Coronary Drug Project med det kemiskt och farmakologiskt relaterade läkemedlet klofibrat. Coronary Drug Project var en 6-årig randomiserad, dubbelblind studie som involverade 1000 klofibrater, 1000 nikotinsyra- och 3000 placebopatienter med känd kranskärlssjukdom. En kliniskt och statistiskt signifikant minskning av hjärtinfarkter sågs i den samtidiga nikotinsyragruppen jämfört med placebo; ingen minskning sågs med klofibrat.
Verkningsmekanismen för gemfibrozil har inte definitivt fastställts. Hos människa har LOPID 300 mg visat sig hämma perifer lipolys och minska leverextraktionen av fria fettsyror, vilket minskar levertriglyceridproduktionen. LOPID 300mg hämmar syntesen och ökar clearance av VLDL-bärarapolipoprotein B, vilket leder till en minskning av VLDL-produktionen.
Djurstudier tyder på att gemfibrozil, förutom att höja HDL-kolesterol, kan minska inkorporeringen av långkedjiga fettsyror i nybildade triglycerider, påskynda omsättningen och avlägsnandet av kolesterol från levern och öka utsöndringen av kolesterol i avföringen. LOPID 300mg absorberas väl från mag-tarmkanalen efter oral administrering. Maximala plasmanivåer inträffar inom 1 till 2 timmar med en plasmahalveringstid på 1,5 timmar efter flera doser.
Gemfibrozil absorberas fullständigt efter oral administrering av LOPID 300 mg tabletter och når maximala plasmakoncentrationer 1 till 2 timmar efter dosering. Gemfibrozils farmakokinetik påverkas av tidpunkten för måltider i förhållande till tidpunkten för dosering. I en studie (ref. 4) ökade både hastigheten och graden av absorption av läkemedlet signifikant när det administrerades 0,5 timme före måltid. Genomsnittlig AUC minskade med 14–44 % när LOPID administrerades efter måltid jämfört med 0,5 timme före måltid. I en efterföljande studie var absorptionshastigheten av LOPID 300 mg maximal vid administrering 0,5 timme före måltid med Cmax 50–60 % högre än när det gavs antingen i samband med måltid eller fasta. I denna studie fanns det inga signifikanta effekter på AUC för tidpunkten för dosen i förhållande till måltider (se DOSERING OCH ADMINISTRERING ).
LOPID genomgår huvudsakligen oxidation av en ringmetylgrupp för att successivt bilda en hydroximetyl- och en karboxylmetabolit. Ungefär sjuttio procent av den administrerade humana dosen utsöndras i urinen, mestadels som glukuronidkonjugatet, med mindre än 2 % utsöndras som oförändrat gemfibrozil. Sex procent av dosen står för avföringen. Gemfibrozil är starkt bundet till plasmaproteiner och det finns potential för förskjutningsinteraktioner med andra läkemedel (se FÖRSIKTIGHETSÅTGÄRDER ).
PATIENTINFORMATION
Ingen information lämnas. Vänligen se VARNINGAR och FÖRSIKTIGHETSÅTGÄRDER avsnitt.
