Zanaflex 2mg, 4mg Tizanidine Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Zanaflex 2mg och hur används det?
Zanaflex 2mg är ett receptbelagt läkemedel som används för att behandla symtom på muskelstelhet (spasticitet) i samband med tillstånd som cerebral pares eller andra neurologiska störningar. Zanaflex 2mg kan användas ensamt eller tillsammans med andra läkemedel.
Zanaflex 2mg tillhör en klass av läkemedel som kallas Central Alpha-2-Adrenerge agonister.
Det är inte känt om Zanaflex är säkert och effektivt för barn.
Vilka är de möjliga biverkningarna av Zanaflex?
Zanaflex 2mg kan orsaka allvarliga biverkningar inklusive:
- lågt blodtryck,
- onormala leverfunktionstester,
- dåsighet,
- hallucinationer,
- överdriven dåsighet,
- långsam hjärtfrekvens,
- torr mun,
- trötthet och
- svaghet
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Zanaflex inkluderar:
- torr mun,
- trötthet,
- svaghet,
- Trötthet,
- trötthet,
- yrsel,
- urinvägsinfektion,
- förstoppning,
- onormala leverfunktionstester,
- kräkningar,
- talstörning,
- lat öga (amblyopi),
- Urinfrekvens,
- influensa symptom,
- okontrollerade muskelrörelser,
- nervositet,
- ont i halsen, och
- rinnande näsa
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Zanaflex. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
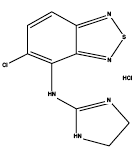
Zanaflex® (tizanidinhydroklorid) är en central alfa2-adrenerg agonist. Tizanidine HCl är ett vitt till benvitt, fint kristallint pulver, som är luktfritt eller med en svag karakteristisk lukt. Tizanidin är svagt lösligt i vatten och metanol; lösligheten i vatten minskar när pH ökar. Dess kemiska namn är 5-klor-4-(2-imidazolin-2-ylamino)-2,1,3-bensotiadiazolmonohydroklorid. Tizanidins molekylformel är C9H8ClN5S-HCl, dess molekylvikt är 290,2 och dess strukturformel är:
Zanaflex 4mg Capsules® levereras som 2, 4 och 6 mg kapslar för oral administrering. Zanaflex Capsules® innehåller den aktiva ingrediensen, tizanidinhydroklorid (2,29 mg motsvarande 2 mg tizanidinbas, 4,58 mg motsvarande 4 mg tizanidinbas, och 6,87 mg motsvarande 6 mg tizanidinbas), och de inaktiva ingredienserna, hypromellos, kiseldioxid sockersfärer, titandioxid, gelatin och färgämnen.
Zanaflex® tabletter levereras som 4 mg tabletter för oral administrering. Zanaflex® tabletter innehåller den aktiva ingrediensen, tizanidinhydroklorid (4,58 mg motsvarande 4 mg tizanidinbas), och de inaktiva ingredienserna, kolloidal kiseldioxid, stearinsyra, mikrokristallin cellulosa och vattenfri laktos.
INDIKATIONER
Zanaflex är indicerat för behandling av spasticitet. På grund av den korta varaktigheten av terapeutisk effekt, bör behandling med Zanaflex reserveras för de dagliga aktiviteter och tillfällen då lindring av spasticitet är viktigast [se DOSERING OCH ADMINISTRERING ].
DOSERING OCH ADMINISTRERING
Doseringsinformation
Zanaflex 2mg Capsules® eller Zanaflex® tabletter kan förskrivas med eller utan mat. När formuleringen väl har valts och beslutet att ta med eller utan mat har tagits, bör denna behandlingsregimen inte ändras.
Mat har komplexa effekter på tizanidins farmakokinetik, som skiljer sig åt med de olika formuleringarna. Zanaflex kapslar och Zanaflex tabletter är bioekvivalenta med varandra under fasta (mer än 3 timmar efter en måltid), men inte under utfodring (inom 30 minuter efter en måltid). Dessa farmakokinetiska skillnader kan resultera i kliniskt signifikanta skillnader vid byte av administrering av tabletter och kapslar och vid byte av administrering mellan föda eller fastande. Dessa förändringar kan resultera i ökade biverkningar eller fördröjd eller snabbare aktivitetsstart, beroende på bytet. Av denna anledning bör förskrivaren vara väl förtrogen med förändringarna i kinetiken i samband med dessa olika tillstånd [se KLINISK FARMAKOLOGI ].
Den rekommenderade startdosen är 2 mg. Eftersom effekten av Zanaflex når sin topp cirka 1 till 2 timmar efter dosering och försvinner mellan 3 till 6 timmar efter dosering, kan behandlingen upprepas med 6 till 8 timmars intervall efter behov, till maximalt tre doser på 24 timmar.
Doseringen kan gradvis ökas med 2 mg till 4 mg vid varje dos, med 1 till 4 dagar mellan dosökningarna, tills en tillfredsställande minskning av muskeltonus uppnås. Den totala dagliga dosen bör inte överstiga 36 mg. Enstaka doser större än 16 mg har inte studerats.
Dosering hos patienter med nedsatt njurfunktion
Zanaflex ska användas med försiktighet hos patienter med njurinsufficiens (kreatininclearance VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Dosering hos patienter med nedsatt leverfunktion
Zanaflex 4mg ska användas med försiktighet till patienter med nedsatt leverfunktion. Hos dessa patienter bör de individuella doserna reduceras under titrering. Om högre doser krävs, bör individuella doser ökas snarare än doseringsfrekvensen. Övervakning av aminotransferasnivåer rekommenderas för baseline och 1 månad efter att maximal dos uppnåtts, eller om leverskada misstänks [se Användning i specifika populationer ].
Utsättning av läkemedel
Om behandlingen behöver avbrytas, särskilt hos patienter som har fått höga doser (20 mg till 36 mg dagligen) under långa perioder (9 veckor eller mer) eller som kan vara på samtidig behandling med narkotika, ska dosen minskas långsamt ( 2 mg till 4 mg per dag) för att minimera risken för abstinens och rebound hypertoni, takykardi och hypertoni [se Narkotikamissbruk och beroende ].
HUR LEVERERAS
Doseringsformer och styrkor
Kapslar
mg: Ljusblå ogenomskinlig kropp med en ljusblå ogenomskinlig lock med "2 MG" tryckt på locket 4 mg: Vit ogenomskinlig kropp med en blå ogenomskinlig lock med "4 MG" tryckt på locket 6 mg: Blå ogenomskinlig kropp med en vit rand och blå ogenomskinlig lock med "6 MG" tryckt på locket
Tabletter
4 mg vita, odragerade tabletter med en fyrkantig skåra på ena sidan och präglad med "A594" på den andra sidan
Förvaring Och Hantering
Zanaflex Capsules®
Zanaflex Capsules® (tizanidinhydroklorid) kapslar finns i tre styrkor som tvådelade hårda gelatinkapslar innehållande tizanidinhydroklorid 2,29 mg, 4,58 mg och 6,87 mg, motsvarande 2 mg, 4 mg och 6 mg tizanidinbas.
2 mg kapslarna har en ljusblå ogenomskinlig kropp med en ljusblå ogenomskinlig lock med "2 MG" tryckt på locket: flaskor med 150 kapslar ( NDC 70515-602-15)
4 mg kapslarna har en vit ogenomskinlig kropp med en blå ogenomskinlig lock med "4 MG" tryckt på locket: flaskor med 150 kapslar ( NDC 70515-604-15)
mg kapslarna har en blå ogenomskinlig kropp med en vit rand och blå ogenomskinlig kapsyl med "6 MG" tryckt på kapslarna: flaskor med 150 kapslar ( NDC 70515-606-15)
Förvara vid 25°C (77°F); utflykter tillåtna till 15°C till 30°C (59°F till 86°F) [se USP-kontrollerad rumstemperatur ]. Dispensera i behållare med barnsäker förslutning.
Zanaflex® tabletter
Zanaflex® (tizanidinhydroklorid) tabletter finns tillgängliga som 4 mg vita, obelagda tabletter innehållande tizanidinhydroklorid 4,58 mg, motsvarande 4 mg tizanidinbas. Tabletterna har en fyrkantig skåra på ena sidan och är präglade med "A594" på den andra sidan. Tabletter tillhandahålls enligt följande: flaskor med 150 tabletter (NDC 70515-594-15).
Förvara vid 25°C (77°F); utflykter tillåtna till 15°C till 30°C (59°F till 86°F) [se USP-kontrollerad rumstemperatur ].
Dispensera i behållare med barnsäker förslutning.
Tillverkad för: Covis Pharma Zug, 6300 Schweiz. Reviderad: Dec 2020
BIEFFEKTER
Följande biverkningar beskrivs på andra ställen i andra avsnitt av förskrivningsinformationen:
- Hypotoni [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Leverskada [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Sedation [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hallucinos/psykotisk-liknande symtom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Överkänslighetsreaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska prövningar
Eftersom kliniska studier utförs under mycket varierande förhållanden, kan biverkningsfrekvenser som observerats i de kliniska studierna av ett läkemedel inte direkt jämföras med frekvensen i de kliniska studierna av ett annat läkemedel och återspeglar kanske inte frekvensen som observerats i klinisk praxis.
Tre dubbelblinda, randomiserade, placebokontrollerade kliniska studier utfördes för att utvärdera effekten av tizanidin på spasticitetskontroll. Två studier utfördes på patienter med multipel skleros och en på patienter med ryggmärgsskada. Varje studie hade en 13-veckors aktiv behandlingsperiod som inkluderade en 3-veckors titreringsfas till den maximalt tolererade dosen upp till 36 mg/dag i tre uppdelade doser, en 9-veckors platåfas där dosen av tizanidin hölls konstant och en 1 veckas dosnedtrappning. Totalt fick 264 patienter tizanidin och 261 patienter fick placebo. I de tre studierna varierade patientåldern från 15-69 år och 51,4 procent var kvinnor. Mediandosen under platåfasen varierade från 20-28 mg/dag.
De vanligaste biverkningarna som rapporterats i placebokontrollerade kliniska studier med multipla doser med 264 patienter med spasticitet var muntorrhet, somnolens/sedation, asteni (svaghet, trötthet och/eller trötthet) och yrsel. Tre fjärdedelar av patienterna bedömde händelserna som milda till måttliga och en fjärdedel av patienterna bedömde händelserna som allvarliga. Dessa händelser verkade vara dosrelaterade.
Tabell 1 listar tecken och symtom som rapporterades hos mer än 2 % av patienterna i tre placebokontrollerade multipeldosstudier som fick Zanaflex där frekvensen i Zanaflex-gruppen var högre än placebogruppen. För jämförelsesyften anges också motsvarande frekvens av händelsen (per 100 patienter) bland placebobehandlade patienter.
I den placebokontrollerade singeldosstudien med 142 patienter med spasticitet på grund av multipel skleros (Studie 1) [se Kliniska studier ], tillfrågades patienterna specifikt om de hade upplevt någon av de fyra vanligaste biverkningarna: muntorrhet, somnolens (sömnighet), asteni (svaghet, trötthet och/eller trötthet) och yrsel. Dessutom observerades hypotoni och bradykardi. Förekomsten av dessa reaktioner sammanfattas i tabell 2. Andra händelser rapporterades i allmänhet med en frekvens av 2 % eller mindre.
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats under användning av Zanaflex efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering.
Vissa händelser, såsom somnolens, muntorrhet, hypotoni, sänkt blodtryck, bradykardi, yrsel, svaghet eller asteni, muskelspasmer, hallucinationer, trötthet, avvikande leverfunktionstester och levertoxicitet, har observerats efter marknadsföring och kliniska prövningar och diskuteras. i tidigare avsnitt av detta dokument.
Följande biverkningar har identifierats som inträffade efter marknadsföringen av Zanaflex. Baserat på informationen om dessa reaktioner kan ett orsakssamband med Zanaflex inte helt uteslutas. Händelserna listas i ordning efter minskande klinisk betydelse; allvarlighetsgraden i eftermarknadsföringsinställningen rapporteras inte.
- Stevens Johnsons syndrom
- Anafylaktisk reaktion
- Exfoliativ dermatit
- Ventrikulär takykardi
- Hepatit
- Konvulsion
- Depression
- Artralgi
- Parestesi
- Utslag
- Darrning
LÄKEMEDELSINTERAKTIONER
Fluvoxamin
Samtidig användning av fluvoxamin och Zanaflex 4mg är kontraindicerat. Förändringar i farmakokinetiken för tizanidin när det administreras med fluvoxamin resulterade i signifikant sänkt blodtryck, ökad dåsighet och ökad psykomotorisk funktionsnedsättning [se KONTRAINDIKATIONER och KLINISK FARMAKOLOGI ].
Ciprofloxacin
Samtidig användning av ciprofloxacin och Zanaflex är kontraindicerad. Förändringar i farmakokinetiken för tizanidin när det administreras med ciprofloxacin resulterade i signifikant sänkt blodtryck, ökad dåsighet och ökad psykomotorisk funktionsnedsättning [se KONTRAINDIKATIONER och KLINISK FARMAKOLOGI ].
Andra CYP1A2-hämmare än fluvoxamin och ciprofloxacin
På grund av potentiella läkemedelsinteraktioner, samtidig användning av Zanaflex med andra CYP1A2-hämmare, såsom zileuton, fluorokinoloner andra än starka CYP1A2-hämmare (som är kontraindicerade), antiarytmika (amiodaron, mexiletin, propafenon och verapamil, preventivmedel, orala antikonceptiva medel), facimetidin, oralt, preventivmedel. acyklovir och tiklopidin) bör undvikas. Om deras användning är kliniskt nödvändig, bör behandlingen inledas med 2 mg dos och ökas i 2-4 mg steg dagligen baserat på patientens svar på behandlingen. Om biverkningar som hypotoni, bradykardi eller överdriven dåsighet uppstår, minska eller avbryt behandlingen med Zanaflex [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och KLINISK FARMAKOLOGI ].
Orala preventivmedel
Samtidig användning av Zanaflex 2mg och orala preventivmedel rekommenderas inte. Men om samtidig användning är kliniskt nödvändig, initiera Zanaflex 4 mg med en engångsdos på 2 mg och öka i steg om 2-4 mg dagligen baserat på patientens svar på behandlingen. Om biverkningar som hypotoni, bradykardi eller överdriven dåsighet uppstår, minska eller avbryt behandlingen med Zanaflex [se KLINISK FARMAKOLOGI ].
Alkohol
Alkohol ökar den totala mängden läkemedel i blodomloppet efter en dos av Zanaflex. Detta var associerat med en ökning av biverkningar av Zanaflex. De CNS-depressiva effekterna av Zanaflex och alkohol är additiv [se KLINISK FARMAKOLOGI ].
Andra CNS-depressiva medel
De lugnande effekterna av Zanaflex med CNS-depressiva medel (t.ex. bensodiazepiner, opioider, tricykliska antidepressiva) kan vara additiv. Övervaka patienter som tar Zanaflex 2mg med ett annat CNS-dämpande medel för symtom på överdriven sedering [se KLINISK FARMAKOLOGI ].
a2-adrenerga agonister
Eftersom hypotensiva effekter kan vara kumulativa, rekommenderas det inte att Zanaflex 4mg används tillsammans med andra α2-adrenerga agonister [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Narkotikamissbruk och beroende
Missbruk
Missbrukspotential utvärderades inte i humanstudier. Råttor kunde särskilja tizanidin från saltlösning i ett standarddiskrimineringsparadigm, efter träning, men misslyckades med att generalisera effekterna av morfin, kokain, diazepam eller fenobarbital till tizanidin.
Beroende
Tizanidin är nära besläktat med klonidin, som ofta missbrukas i kombination med narkotika och som är känt för att orsaka återhämtning vid abrupt abstinens. Tre fall av rebound-symtom vid plötslig utsättning av tizanidin har rapporterats. Fallrapporterna tyder på att dessa patienter också missbrukade narkotika. Abstinenssymtom inkluderade högt blodtryck, takykardi, hypertoni, tremor och ångest. Det är mer sannolikt att abstinenssymtom uppstår i fall där höga doser används, särskilt under längre perioder, eller vid samtidig användning av narkotika. Om behandlingen behöver avbrytas ska dosen minskas långsamt för att minimera risken för abstinenssymtom [se DOSERING OCH ADMINISTRERING ].
Apor visades själv administrera tizanidin på ett dosberoende sätt, och plötsligt upphörande av tizanidin gav övergående tecken på abstinens vid doser > 35 gånger den maximala rekommenderade humana dosen på mg/m² basis. Dessa övergående abstinenssymptom (ökad rörelse, ryckningar i kroppen och aversivt beteende gentemot observatören) reverserades inte av administrering av naloxon.
VARNINGAR
Ingår som en del av FÖRSIKTIGHETSÅTGÄRDER sektion.
FÖRSIKTIGHETSÅTGÄRDER
Hypotoni
Tizanidin är en α2-adrenerg agonist som kan ge hypotoni. Synkope har rapporterats i inställningen efter marknadsföring. Risken för signifikant hypotoni kan möjligen minimeras genom titrering av dosen och genom att fokusera uppmärksamheten på tecken och symtom på hypotoni före doshöjning. Dessutom kan patienter som går från liggande till fast upprätt position löpa ökad risk för hypotoni och ortostatiska effekter.
Övervaka hypotoni när Zanaflex används hos patienter som samtidigt får antihypertensiv behandling. Det rekommenderas inte att Zanaflex 2mg används tillsammans med andra α2-adrenerga agonister. Kliniskt signifikant hypotension (minskning av både systoliskt och diastoliskt tryck) har rapporterats vid samtidig administrering av antingen fluvoxamin eller ciprofloxacin och enstaka doser på 4 mg Zanaflex. Därför är samtidig användning av Zanaflex och fluvoxamin eller med ciprofloxacin, potenta hämmare av CYP1A2, kontraindicerat [se KONTRAINDIKATIONER och LÄKEMEDELSINTERAKTIONER ].
Risk för leverskada
Zanaflex kan orsaka hepatocellulär leverskada. Zanaflex 4mg ska användas med försiktighet till patienter med nedsatt leverfunktion. Övervakning av aminotransferasnivåer rekommenderas för baseline och 1 månad efter att maximal dos uppnåtts, eller om leverskada misstänks [se DOSERING OCH ADMINISTRERING och Användning i specifika populationer ].
Sedation
Zanaflex kan orsaka sedering, vilket kan störa den dagliga aktiviteten. I multipeldosstudierna nådde prevalensen av patienter med sedering sin topp efter den första veckans titrering och förblev sedan stabil under hela underhållsfasen av studien. De CNS-depressiva effekterna av Zanaflex med alkohol och andra CNS-depressiva medel (t.ex. bensodiazepiner, opioider, tricykliska antidepressiva) kan vara additiv. Övervaka patienter som tar Zanaflex 4mg tillsammans med ett annat CNS-dämpande medel för symtom på överdriven sedering [se LÄKEMEDELSINTERAKTIONER ].

Hallucinos/psykotisk-liknande symtom
Zanaflex 4 mg användning har associerats med hallucinationer. Bildade synhallucinationer eller vanföreställningar har rapporterats hos 5 av 170 patienter (3%) i två nordamerikanska kontrollerade kliniska studier. De flesta av patienterna var medvetna om att händelserna var overkliga. En patient utvecklade psykos i samband med hallucinationerna. En patient av dessa 5 fortsatte att ha problem i minst 2 veckor efter avslutad behandling med tizanidin. Överväg att avbryta Zanaflex hos patienter som utvecklar hallucinationer.
Interaktion med CYP1A2-hämmare
På grund av potentiella läkemedelsinteraktioner är Zanaflex 4mg kontraindicerat hos patienter som tar potenta CYP1A2-hämmare, såsom fluvoxamin eller ciprofloxacin. Biverkningar som hypotoni, bradykardi eller överdriven dåsighet kan uppstå när Zanaflex tas tillsammans med andra CYP1A2-hämmare, såsom zileuton, fluorokinoloner andra än ciprofloxacin (som är kontraindicerat), antiarytmika (amiodaron, mexiletin, peroralt propafenidin, famotci, propafenidin, oralt). preventivmedel, acyklovir och tiklopidin). Samtidig användning bör undvikas om inte behovet av Zanaflex 2 mg-behandling är kliniskt uppenbart. Använd i sådana fall med försiktighet [se LÄKEMEDELSINTERAKTIONER och KLINISK FARMAKOLOGI ].
Överkänslighetsreaktioner
Zanaflex kan orsaka anafylaxi. Tecken och symtom inklusive andningsproblem, urtikaria och angioödem i svalg och tunga har rapporterats. Patienterna ska informeras om tecken och symtom på allvarliga allergiska reaktioner och instrueras att avbryta behandlingen med Zanaflex och omedelbart söka läkarvård om dessa tecken och symtom uppstår [se KONTRAINDIKATIONER ].
Ökad risk för biverkningar hos patienter med nedsatt njurfunktion
Zanaflex ska användas med försiktighet hos patienter med njurinsufficiens (kreatininclearance DOSERING OCH ADMINISTRERING och Användning i specifika populationer ].
Uttagsbiverkningar
Abstinensbiverkningar inkluderar rebound-hypertoni, takykardi och hypertoni. För att minimera risken för dessa reaktioner, särskilt hos patienter som har fått höga doser (20 till 28 mg dagligen) under långa perioder (9 veckor eller mer) eller som kan vara på samtidig behandling med narkotika, bör dosen minskas långsamt (2 till 4 mg per dag) [se DOSERING OCH ADMINISTRERING ].
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Carcinogenes
Tizanidin administrerades till möss i 78 veckor i orala doser upp till 16 mg/kg/dag, vilket är 2 gånger den maximala rekommenderade humandosen (MRHD) på 36 mg/dag på basis av kroppsyta (mg/m²). Tizanidin administrerades till råttor i 104 veckor i orala doser upp till 9 mg/kg/dag, vilket är 2,5 gånger MRHD på mg/m²-basis. Det fanns ingen ökning av tumörer hos någon av arterna.
Mutagenes
Tizanidin var negativ i in vitro (bakteriell omvänd mutation [Ames], genmutation hos däggdjur och kromosomavvikelsetest i däggdjursceller) och in vivo (benmärgsmikronkärna och cytogenetik).
Nedsättning av fertilitet
Oral administrering av tizanidin till råttor före och under parning och fortsatt under tidig dräktighet hos honor resulterade i minskad fertilitet hos han- och honråttor vid doser på 30 respektive 10 mg/kg/dag. Ingen effekt på fertiliteten observerades vid doser på 10 (man) och 3 (kvinna) mg/kg/dag, vilket är ungefär 3 gånger respektive liknar MRHD, på mg/m² basis.
Användning i specifika populationer
Graviditet
Risksammanfattning
Det finns inga adekvata data om utvecklingsrisken förknippad med användning av Zanaflex 2mg hos gravida kvinnor. I djurstudier resulterade administrering av tizanidin under graviditet i utvecklingstoxicitet (embryofetal och postnatal avkommamortalitet och tillväxtbrist) vid doser lägre än de som används kliniskt, som inte var associerade med maternell toxicitet (se Djurdata ).
I den allmänna befolkningen i USA är den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall i kliniskt erkända graviditeter 2 % - 4 % respektive 15 % - 20 %. Bakgrundsrisken för stora fosterskador och missfall för den indikerade populationen är okänd.
Data
Djurdata
Oral administrering av tizanidin (0,3 till 100 mg/kg/dag) till dräktiga råttor under organogenesperioden resulterade i embryofetal och postnatal avkommamortalitet och minskningar i kroppsvikt vid doser på 30 mg/kg/dag och högre. Maternell toxicitet observerades vid den högsta testade dosen. Dosen utan effekt för embryofetal utvecklingstoxicitet hos råttor (3 mg/kg/dag) liknar den maximala rekommenderade humandosen (MRHD) på 36 mg/dag på basis av kroppsyta (mg/m²).
Oral administrering av tizanidin (1 till 100 mg/kg/dag) till dräktiga kaniner under organogenesperioden resulterade i embryofetal och postnatal avkommamortalitet vid alla doser. Maternell toxicitet observerades vid den högsta testade dosen. Oral administrering av tizanidin (10 och 30 mg/kg/dag) under den perinatala perioden av graviditeten (2-6 dagar före förlossningen) resulterade i ökad postnatal avkommamortalitet vid båda doserna. En dos utan effekt för embryofetal utvecklingstoxicitet hos kanin identifierades inte. Den lägsta testade dosen (1 mg/kg/dag) är lägre än MRHD på mg/m² basis.
I en pre- och postnatal utvecklingsstudie på råttor resulterade oral administrering av tizanidin (3 till 30 mg/kg/dag) i ökad postnatal avkommamortalitet. En dos utan effekt för pre- och postnatal utvecklingstoxicitet identifierades inte. Den lägsta testade dosen (3 mg/kg/dag) liknar MRHD på mg/m²-basis.
Laktation
Risksammanfattning
Det finns inga data om förekomsten av tizanidin i bröstmjölk, effekterna på det ammade barnet eller effekterna på produktionen av bröstmjölk. Djurstudier har rapporterat förekomst av tizanidin i mjölken från lakterande djur.
Utvecklings- och hälsofördelarna med amning bör beaktas tillsammans med moderns kliniska behov av Zanaflex 4 mg och eventuella negativa effekter på det ammade barnet från Zanaflex eller från det underliggande moderns tillståndet.
Kvinnor Och Hanar Av Reproduktionspotential
Det finns inga adekvata och välkontrollerade studier på människa om effekten av Zanaflex 4 mg på kvinnlig eller manlig reproduktionspotential. Oral administrering av tizanidin till han- och honråttor resulterade i negativa effekter på fertiliteten [se Icke-klinisk toxikologi ].
Pediatrisk användning
Säkerhet och effektivitet hos pediatriska patienter har inte fastställts.
Geriatrisk användning
Zanaflex 2mg är känt för att utsöndras till stor del via njurarna, och risken för biverkningar av detta läkemedel kan vara större hos patienter med nedsatt njurfunktion. Eftersom äldre patienter är mer benägna att ha nedsatt njurfunktion, bör man vara försiktig vid val av dos, och det kan vara användbart att övervaka njurfunktionen.
Kliniska studier av Zanaflex 2 mg inkluderade inte tillräckligt många försökspersoner i åldern 65 år och äldre för att avgöra om de svarar annorlunda än yngre försökspersoner. Jämförelse i korsstudier av farmakokinetiska data efter administrering av en engångsdos av 6 mg Zanaflex 2 mg visade att yngre försökspersoner rensade ut läkemedlet fyra gånger snabbare än de äldre försökspersonerna. Hos äldre patienter med njurinsufficiens (kreatininclearance
Nedsatt njurfunktion
Det är känt att Zanaflex utsöndras till stor del via njurarna, och risken för biverkningar av detta läkemedel kan vara större hos patienter med nedsatt njurfunktion. Hos patienter med njurinsufficiens (kreatininclearance DOSERING OCH ADMINISTRERING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och KLINISK FARMAKOLOGI ].
Nedsatt leverfunktion
Inverkan av nedsatt leverfunktion på tizanidins farmakokinetik har inte utvärderats. Eftersom tizanidin i stor utsträckning metaboliseras i levern, förväntas nedsatt leverfunktion ha betydande effekter på tizanidins farmakokinetik [se DOSERING OCH ADMINISTRERING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , och KLINISK FARMAKOLOGI ].
ÖVERDOS
En genomgång av säkerhetsövervakningsdatabasen avslöjade fall av avsiktlig och oavsiktlig överdosering av Zanaflex. Några av fallen ledde till dödsfall och många av de avsiktliga överdoserna var med flera läkemedel inklusive CNS-dämpande medel. De kliniska manifestationerna av överdosering av tizanidin överensstämde med dess kända farmakologi. I de flesta fall observerades en minskning av sensorium inklusive letargi, somnolens, förvirring och koma. Deprimerad hjärtfunktion observeras också inklusive oftast bradykardi och hypotoni. Andningsdepression är ett annat vanligt drag vid överdosering av tizanidin.
Om överdosering inträffar, bör grundläggande åtgärder vidtas för att säkerställa lämpligheten av en luftväg och övervakning av kardiovaskulära system och andningssystem. Tizanidin är ett lipidlösligt läkemedel som endast är svagt lösligt i vatten och metanol. Därför är det sannolikt inte att dialys är en effektiv metod för att avlägsna läkemedel från kroppen. I allmänhet försvinner symtomen inom en till tre dagar efter avslutad behandling med tizanidin och administrering av lämplig behandling. På grund av den liknande verkningsmekanismen liknar symtomen och behandlingen av överdosering av tizanidin den efter överdosering av klonidin. För den senaste informationen om hantering av överdosering, kontakta ett giftkontrollcenter.
KONTRAINDIKATIONER
Zanaflex är kontraindicerat hos patienter som tar potenta hämmare av CYP1A2, såsom fluvoxamin eller ciprofloxacin [se LÄKEMEDELSINTERAKTIONER ].
KLINISK FARMAKOLOGI
Handlingsmekanism
Tizanidin är en central alfa-2-adrenerg receptoragonist och minskar förmodligen spasticiteten genom att öka presynaptisk hämning av motorneuroner. Effekterna av tizanidin är störst på polysynaptiska vägar. Den övergripande effekten av dessa åtgärder tros minska underlättandet av spinala motorneuroner.
Farmakokinetik
Absorption och distribution
Efter oral administrering absorberas tizanidin i princip fullständigt. Den absoluta orala biotillgängligheten av tizanidin är cirka 40 % (CV = 24 %), på grund av omfattande first-pass levermetabolism. Tizanidin distribueras omfattande i hela kroppen med en genomsnittlig distributionsvolym vid steady state på 2,4 l/kg (CV = 21%) efter intravenös administrering till friska vuxna frivilliga. Tizanidin är till cirka 30 % bundet till plasmaproteiner.
Skillnader mellan Zanaflex 4mg Capsules® och Zanaflex® tabletter
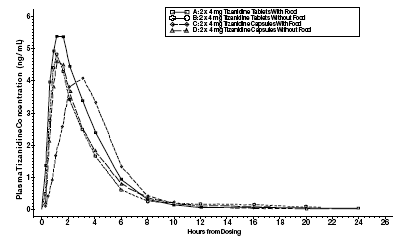
Zanaflex 2mg Capsules® och Zanaflex® tabletter är bioekvivalenta med varandra under fasta, men inte under matningsförhållanden. En engångsdos av antingen två 4 mg tabletter eller två 4 mg kapslar administrerades under utfodrade och fastande förhållanden i en öppen, fyra periods randomiserad överkorsningsstudie på 96 frivilliga försökspersoner, av vilka 81 var kvalificerade för den statistiska analysen. Efter oral administrering av antingen tabletten eller kapseln (i fastande tillstånd) inträffade maximala plasmakoncentrationer av tizanidin 1,0 timmar efter dosering med en halveringstid på cirka 2 timmar. När två 4 mg tabletter administrerades med mat ökade den genomsnittliga maximala plasmakoncentrationen med cirka 30 %, och mediantiden till maximal plasmakoncentration ökades med 25 minuter, till 1 timme och 25 minuter. Däremot, när två 4 mg kapslar administrerades med mat, minskade den genomsnittliga maximala plasmakoncentrationen med 20 %, mediantiden till maximal plasmakoncentration ökade med 2 till 3 timmar. Följaktligen är medel-Cmax för kapseln när den administreras med föda cirka 66 % av Cmax för tabletten när den administreras med föda. Mat ökade också absorptionsgraden för både tabletter och kapslar. Ökningen med tabletten (~30%) var signifikant större än med kapseln (~10%). När var och en administrerades tillsammans med mat var följaktligen mängden absorberad från kapseln cirka 80 % av mängden absorberad från tabletten. Administrering av kapselinnehållet stänkt på äppelmos var inte bioekvivalent med administrering av en intakt kapsel under fastande förhållanden. Administrering av kapselinnehållet på äppelmos resulterade i en 15 %–20 % ökning av Cmax och AUC för tizanidin och en 15 minuters minskning av medianfördröjningen och tiden till maximal koncentration jämfört med administrering av en intakt kapsel under fasta.
Figur 1: Genomsnittlig Tizanidinkoncentration vs. tidsprofiler för Zanaflex tabletter och kapslar (2 × 4 mg) under fasta och matade förhållanden
Metabolism och utsöndring
Tizanidin har linjär farmakokinetik över doserna som studerats i klinisk utveckling (1-20 mg). Tizanidin har en halveringstid på cirka 2,5 timmar (CV=33%). Cirka 95 % av en administrerad dos metaboliseras. Det primära cytokrom P450-isoenzymet som är involverat i tizanidinmetabolismen är CYP1A2. Tizanidinmetaboliter är inte kända för att vara aktiva; deras halveringstider sträcker sig från 20 till 40 timmar.
Efter engångs- och multipel oral dosering av 14C-tizanidin återfanns i genomsnitt 60 % och 20 % av den totala radioaktiviteten i urinen respektive avföringen.
Specifika populationer
Ålder effekter
Ingen specifik farmakokinetisk studie utfördes för att undersöka ålderseffekter. Jämförelse av korsstudier av farmakokinetiska data efter administrering av en engångsdos av 6 mg Zanaflex 2 mg visade att yngre försökspersoner rensade ut läkemedlet fyra gånger snabbare än de äldre försökspersonerna. Zanaflex 4mg har inte utvärderats hos barn [se Användning i specifika populationer ].
Nedsatt leverfunktion
Inverkan av nedsatt leverfunktion på tizanidins farmakokinetik har inte utvärderats. Eftersom tizanidin i stor utsträckning metaboliseras i levern, förväntas nedsatt leverfunktion ha betydande effekter på tizanidins farmakokinetik. Zanaflex rekommenderas inte till denna patientpopulation [se Användning i specifika populationer ].
Nedsatt njurfunktion
Tizanidinclearance minskar med mer än 50 % hos äldre patienter med njurinsufficiens (kreatininclearance VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Användning i specifika populationer ].
Genuseffekter
Ingen specifik farmakokinetisk studie utfördes för att undersöka könseffekter. Retrospektiv analys av farmakokinetiska data, efter administrering av engångsdos och multipeldos av 4 mg Zanaflex 2 mg, visade dock att kön inte hade någon effekt på farmakokinetiken för tizanidin.
Raseffekter
Farmakokinetiska skillnader på grund av ras har inte studerats.
Läkemedelsinteraktioner
CYP1A2-hämmare
Interaktionen mellan Zanaflex och antingen fluvoxamin eller ciprofloxacin beror med största sannolikhet på hämning av CYP1A2 av fluvoxamin eller ciprofloxacin. Effekten av fluvoxamin på farmakokinetiken för en engångsdos på 4 mg Zanaflex studerades hos 10 friska försökspersoner. Cmax, AUC och halveringstiden för tizanidin ökade med 12-faldigt, 33-faldigt respektive 3-faldigt. Effekten av ciprofloxacin på farmakokinetiken av en engångsdos på 4 mg Zanaflex 4 mg studerades hos 10 friska försökspersoner. Cmax och AUC för tizanidin ökade med 7-faldigt respektive 10-faldigt [se KONTRAINDIKATIONER ].
Även om det inte har gjorts några kliniska studier som utvärderar effekterna av andra CYP1A2-hämmare på tizanidin, andra CYP1A2-hämmare, såsom zileuton, andra fluorokinoloner, antiarytmika (amiodaron, mexiletin, propafenon och verapamil), cimetidin, cyklo- och antiarytmika, cimetidin, peroralt cyklolopidin, fa, motidin, kan också leda till avsevärda ökningar av tizanidin blodkoncentrationer [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
In vitro-studier av cytokrom P450 isoenzymer med humana levermikrosomer indikerar att varken tizanidin eller huvudmetaboliterna sannolikt påverkar metabolismen av andra läkemedel som metaboliseras av cytokrom P450 isoenzymer.
Orala preventivmedel
Ingen specifik farmakokinetisk studie utfördes för att undersöka interaktionen mellan orala preventivmedel och Zanaflex. Retrospektiv analys av populationsfarmakokinetiska data efter administrering av engångs- och multipla doser av 4 mg Zanaflex visade dock att kvinnor som samtidigt tog orala preventivmedel hade 50 % lägre clearance av tizanidin jämfört med kvinnor som inte fick orala preventivmedel [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Paracetamol
Tizanidin fördröjde Tmax för paracetamol med 16 minuter. Paracetamol påverkade inte farmakokinetiken för tizanidin.
Alkohol
Alkohol ökade AUC för tizanidin med cirka 20 %, samtidigt som det ökade dess Cmax med cirka 15 %. Detta var förknippat med en ökning av biverkningar av tizanidin. De CNS-dämpande effekterna av tizanidin och alkohol är additiv.
Kliniska studier
Tizanidins förmåga att minska ökad muskeltonus associerad med spasticitet visades i två adekvata och välkontrollerade studier på patienter med multipel skleros eller ryggmärgsskada (Studier 1 och 2).
Enkeldosstudie hos patienter med multipel skleros med spasticitet
I studie 1 randomiserades patienter med multipel skleros till att få enstaka orala doser av läkemedel eller placebo. Patienter och bedömare var blinda för behandlingsuppdrag och ansträngningar gjordes för att minska sannolikheten för att bedömare indirekt skulle bli medvetna om behandlingsuppdrag (t.ex. gav de inte direkt vård till patienter och förbjöds att ställa frågor om biverkningar). Totalt fick 140 patienter placebo, 8 mg eller 16 mg Zanaflex.
Svaret bedömdes genom fysisk undersökning; muskeltonus bedömdes på en femgradig skala (Ashworth-poäng), med en poäng på 0 som användes för att beskriva normal muskeltonus. En poäng på 1 indikerade en lätt spastisk fångst medan en poäng på 2 indikerade mer markant muskelmotstånd. En poäng på 3 användes för att beskriva en avsevärd ökning av tonen, vilket gjorde passiv rörelse svår. En muskel immobiliserad av spasticitet gavs poängen 4. Spasmräkningar samlades också in.
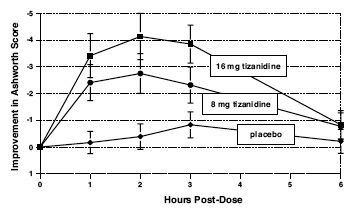
Bedömningar gjordes 1, 2, 3 och 6 timmar efter behandlingen. En statistiskt signifikant minskning av Ashworth-poängen för Zanaflex 2 mg jämfört med placebo upptäcktes 1, 2 och 3 timmar efter behandling. Figur 2 nedan visar en jämförelse av medelförändringen i muskeltonus från baslinjen mätt med Ashworth-skalan. Den största minskningen av muskeltonus var 1 till 2 timmar efter behandlingen. Senast 6 timmar efter behandlingen kunde muskeltonusen i grupperna 8 och 16 mg Zanaflex 2 mg inte särskiljas från muskeltonus hos placebobehandlade patienter. Inom en given patient var förbättring av muskeltonus korrelerad med plasmakoncentration. Plasmakoncentrationerna varierade från patient till patient vid en given dos. Även om 16 mg gav en större effekt, var biverkningar inklusive hypotoni vanligare och allvarligare än i 8 mg-gruppen. Det fanns inga skillnader i antalet spasmer som förekom i varje grupp.
Figur 2: Enkeldosstudie – medelförändring i muskeltonus från baslinjen mätt med Ashworth-skalan ± 95 % konfidensintervall (ett negativt Ashworth-poäng betyder en förbättring av muskeltonus från baslinjen)
Sju veckors studie på patienter med ryggmärgsskada med spasticitet
I en 7-veckors studie (studie 2) randomiserades 118 patienter med spasticitet sekundärt till ryggmärgsskada till antingen placebo eller Zanaflex. Steg liknande de som togs i den första studien användes för att säkerställa integriteten av blindning.
Patienterna titrerades över 3 veckor upp till en maximal tolererad dos eller 36 mg dagligen i tre olika doser (t.ex. 10 mg på morgonen och eftermiddagen och 16 mg på natten). Patienterna hölls sedan på sin maximalt tolererade dos i ytterligare 4 veckor (dvs underhållsfas). Under underhållsfasen bedömdes muskeltonus på Ashworth-skalan inom en period av 2,5 timmar efter antingen morgon- eller eftermiddagsdosen. Antalet spasmer dagtid registrerades dagligen av patienter.
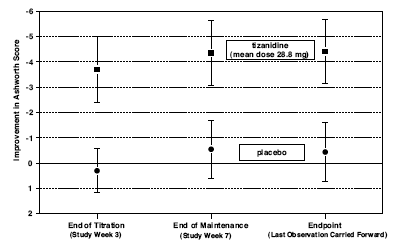
Vid slutpunkten (den protokollspecificerade tidpunkten för resultatbedömning) fanns en statistiskt signifikant minskning av muskeltonus och frekvens av spasmer i den Zanaflex-behandlade gruppen jämfört med placebo. Minskningen av muskeltonus var inte associerad med en minskning av muskelstyrka (ett önskvärt resultat) men ledde inte heller till några konsekventa fördelar hos Zanaflex-behandlade patienter på mätningar av dagliga aktiviteter. Figur 3 nedan visar en jämförelse av medelförändringen i muskeltonus från baslinjen mätt med Ashworth-skalan.
Figur 3: Sjuveckorsstudie – Genomsnittlig förändring i muskeltonus 0,5 - 2,5 timmar efter dosering mätt med Ashworth-skalan ± 95 % konfidensintervall (Negativ Ashworth-poäng betyder en förbättring av muskeltonus från baslinjen)
PATIENTINFORMATION
Allvarliga läkemedelsinteraktioner
Rådgör till patienter att de inte ska ta Zanaflex om de tar fluvoxamin eller ciprofloxacin på grund av den ökade risken för allvarliga biverkningar inklusive kraftigt blodtryckssänkning och sedering. Instruera patienterna att informera sina läkare eller farmaceuter när de börjar eller slutar ta någon medicin på grund av riskerna förknippade med interaktioner mellan Zanaflex och andra läkemedel.
Zanaflex Dosering
Tala om för patienterna att ta Zanaflex 2mg exakt som ordinerats (konsekvent antingen med eller utan mat) och att inte byta mellan tabletter och kapslar. Informera patienterna om att de inte ska ta mer Zanaflex 2 mg än vad som ordinerats på grund av risken för biverkningar vid engångsdoser större än 8 mg eller totala dagliga doser större än 36 mg. Berätta för patienterna att de inte plötsligt ska avbryta behandlingen med Zanaflex 4mg, eftersom rebound-hypertoni och takykardi kan uppstå.
Effekter av Zanaflex
Varna patienter för att de kan uppleva hypotoni och att vara försiktig när de byter från liggande eller sittande till stående. Berätta för patienterna att Zanaflex kan få dem att bli sövda eller somnolenta och att de ska vara försiktiga när de utför aktiviteter som kräver vakenhet, såsom att köra fordon eller använda maskiner. Berätta för patienterna att sederingen kan vara additiv när Zanaflex 4 mg tas i kombination med läkemedel (baklofen, bensodiazepiner) eller substanser (t.ex. alkohol) som verkar som CNS-depressiva. Påminn patienter om att om de är beroende av sin spasticitet för att upprätthålla hållning och balans i rörelse, eller när spasticitet används för att få ökad funktion, att Zanaflex minskar spasticiteten och försiktighet bör användas.
