Brand Temovate 15g Clobetasol Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Temovate och hur används det?
Temovate är ett receptbelagt läkemedel som används för att behandla symtom på plack- och hårbottenpsoriasis och kortikosteroidkänsliga dermatoser. Temovate kan användas ensamt eller tillsammans med andra läkemedel.
Temovate tillhör en klass av läkemedel som kallas kortikosteroider, topikala.
Det är inte känt om Temovate är säkert och effektivt för barn yngre än 12 år.
Vilka är de möjliga biverkningarna av Temovate?
Temovate kan orsaka allvarliga biverkningar inklusive:
- försämring av ditt hudtillstånd,
- rodnad, värme, svullnad, sipprar eller allvarlig irritation av behandlad hud,
- suddig syn,
- tunnelseende,
- ögonsmärta,
- ser glorier runt ljus,
- ökad törst,
- torr mun,
- fruktig andedräkt lukt,
- viktökning i ansikte och axlar,
- långsam sårläkning,
- missfärgning av huden,
- tunn hud,
- ökat kroppsbehåring,
- trötthet,
- humörförändringar,
- menstruationsförändringar, och
- sexuella förändringar
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Temovate inkluderar:
- sveda, klåda, svullnad eller irritation av behandlad hud,
- torr eller sprucken hud,
- rodnad eller skorpa runt hårsäckarna,
- spindelådror,
- bristningar,
- tunn hud,
- utslag eller nässelutslag,
- akne och
- tillfälligt håravfall
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Temovate. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
TEMOVATE® (klobetasolpropionatkräm och salva) Kräm och salva, 0,05 % innehåller den aktiva föreningen clobetasolpropionat, en syntetisk kortikosteroid, för topikal dermatologisk användning. Clobetasol, en analog av prednisolon, har en hög grad av glukokortikoidaktivitet och en liten grad av mineralokortikoidaktivitet.
Kemiskt sett är klobetasolpropionat (11ß,16ß)-21-klor-9-fluor-11-hydroxi-16-metyl-17-(1-oxopropoxi)-pregna-1,4-dien-3,20-dion, och den har följande strukturformel:
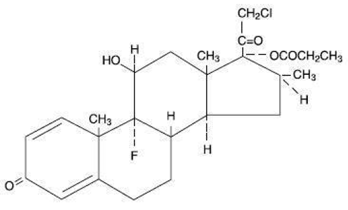
Klobetasolpropionat har molekylformeln C25H32CIFO5 och en molekylvikt på 467. Det är ett vitt till krämfärgat kristallint pulver olösligt i vatten.
TEMOVATE® Cream innehåller klobetasolpropionat 0,5 mg/g i en krämbas av propylenglykol, glycerylmonostearat, cetostearylalkohol, glycerylstearat, PEG 100 stearat, vitt vax, klorokresol, natriumcitrat, citronsyramonohydrat och renat vatten.
TEMOVATE® salva innehåller klobetasolpropionat 0,5 mg/g i en bas av propylenglykol, sorbitan-seskvioleat och vit vaselin.
INDIKATIONER
TEMOVATE® Cream and Ointment är kortikosteroidformuleringar med superhög styrka indikerade för att lindra de inflammatoriska och klådande manifestationerna av kortikosteroidkänsliga dermatoser. Behandling längre än 2 veckor i följd rekommenderas inte, och den totala dosen bör inte överstiga 50 g/vecka på grund av läkemedlets potential att undertrycka hypotalamus-hypofys-binjureaxeln (HPA). Användning till pediatriska patienter under 12 år rekommenderas inte.
Liksom med andra högaktiva kortikosteroider bör behandlingen avbrytas när kontroll har uppnåtts. Om ingen förbättring ses inom 2 veckor kan omprövning av diagnosen bli nödvändig.
DOSERING OCH ADMINISTRERING
Applicera ett tunt lager TEMOVATE® kräm eller salva på de drabbade hudområdena två gånger dagligen och gnugga in försiktigt och helt (se INDIKATIONER OCH ANVÄNDNING ).
TEMOVATE® Cream and Ointment är topikala kortikosteroider med superhög styrka; därför, Behandlingen bör begränsas till 2 veckor i följd och mängder över 50 g/vecka bör inte användas.
Liksom med andra högaktiva kortikosteroider bör behandlingen avbrytas när kontroll har uppnåtts. Om ingen förbättring ses inom 2 veckor kan omprövning av diagnosen bli nödvändig.
TEMOVATE® Cream and Ointment ska inte användas med ocklusiva förband.
Geriatrisk användning
I studier där geriatriska patienter (65 år eller äldre, se FÖRSIKTIGHETSÅTGÄRDER har behandlats med TEMOVATE® kräm eller salva, skiljde sig inte säkerheten från den hos yngre patienter; därför rekommenderas ingen dosjustering.
HUR LEVERERAS
TEMOVATE® (clobetasol propionate cream) Kräm, 0,05 % levereras i:
30 g rör ( NDC 10337-163-30), och 60-g rör ( NDC 10337-163-60).
TEMOVATE® (clobetasol propionate salva) Salva, 0,05 % levereras i:
15 g rör ( NDC 10337-162-15), och 30-g rör ( NDC 10337-162-30).
Förvaras mellan 15° och 30°C (59° och 86°F). TEMOVATE® Cream ska inte förvaras i kylskåp. PharmaDerm
En division av Fougera Pharmaceuticals Inc., Melville, NY 11747 USA. Reviderad: Jan 2012
BIEFFEKTER
I kontrollerade kliniska prövningar var de vanligaste biverkningarna som rapporterats för TEMOVATE® Cream en brännande och stickande känsla hos 1 % av de behandlade patienterna. Mindre frekventa biverkningar var klåda, hudatrofi och sprickor och sprickor i huden.
kontrollerade kliniska prövningar var de vanligaste biverkningarna som rapporterades för TEMOVATE® Ointment brännande känsla, irritation och klåda hos 0,5 % av de behandlade patienterna. Mindre frekventa biverkningar var sveda, sprickbildning, erytem, follikulit, domningar i fingrar, hudatrofi och telangiektasi.
Cushings syndrom har rapporterats hos spädbarn och vuxna som ett resultat av långvarig användning av topikala klobetasolpropionatformuleringar.
Följande ytterligare lokala biverkningar har rapporterats med topikala kortikosteroider, och de kan förekomma oftare vid användning av ocklusiva förband och kortikosteroider med högre styrka. Dessa reaktioner listas i ungefär fallande ordningsföljd: torrhet, acneiforma utbrott, hypopigmentering, perioral dermatit, allergisk kontaktdermatit, sekundär infektion, irritation, striae och miliaria.

LÄKEMEDELSINTERAKTIONER
Ingen information lämnas.
VARNINGAR
Ingen information lämnas. Snälla se FÖRSIKTIGHET avsnitt nedan.
FÖRSIKTIGHETSÅTGÄRDER
Allmän
TEMOVATE® Cream and Ointment ska inte användas vid behandling av rosacea eller perioral dermatit, och ska inte användas i ansikte, ljumskar eller axiller.
Systemisk absorption av topikala kortikosteroider kan ge reversibel HPA-axelsuppression med risk för glukokortikosteroidinsufficiens efter avslutad behandling. Manifestationer av Cushings syndrom, hyperglykemi och glukosuri kan också produceras hos vissa patienter genom systemisk absorption av topikala kortikosteroider under behandling.
Patienter som applicerar en topikal steroid på en stor yta eller på områden under ocklusion bör utvärderas regelbundet för tecken på HPA-axelsuppression. Detta kan göras genom att använda ACTH-stimulering, AM-plasmakortisol och urinfritt kortisoltest. Patienter som får superpotenta kortikosteroider ska inte behandlas i mer än 2 veckor åt gången, och endast små områden ska behandlas åt gången på grund av den ökade risken för HPA-suppression.
TEMOVATE® kräm och salva gav HPA-axeldämpning när den användes i doser så låga som 2 g/dag under 1 vecka hos patienter med eksem.
Om HPA-axelsuppression noteras, bör ett försök göras att dra tillbaka läkemedlet, minska frekvensen av applicering eller att ersätta en mindre potent kortikosteroid. Återhämtning av HPA-axelns funktion sker i allmänhet omedelbart efter utsättning av topikala kortikosteroider. I sällsynta fall kan tecken och symtom på glukokortikosteroidinsufficiens förekomma som kräver kompletterande systemiska kortikosteroider. För information om systemiskt tillskott, se förskrivningsinformation för dessa produkter.
Pediatriska patienter kan vara mer mottagliga för systemisk toxicitet från ekvivalenta doser på grund av deras större förhållande mellan hudyta och kroppsmassa (se FÖRSIKTIGHETSÅTGÄRDER : Pediatrisk användning ).
Om irritation uppstår ska TEMOVATE® Cream and Ointment avbrytas och lämplig behandling inledas. Allergisk kontaktdermatit med kortikosteroider diagnostiseras vanligtvis genom att observera ett misslyckande att läka snarare än att notera en klinisk exacerbation som med de flesta topikala produkter som inte innehåller kortikosteroider. En sådan observation bör bekräftas med lämpliga diagnostiska lapptester.
Om samtidiga hudinfektioner förekommer eller utvecklas, bör ett lämpligt svampdödande eller antibakteriellt medel användas. Om ett gynnsamt svar inte uppstår omedelbart, bör användningen av TEMOVATE® kräm och salva avbrytas tills infektionen har kontrollerats adekvat.
Laboratorietester
Följande tester kan vara till hjälp för att utvärdera patienter för HPA-axelsuppression:
ACTH-stimuleringstest AM plasmakortisoltest Urinfritt kortisoltest
Karcinogenes, Mutagenes, Nedsatt fertilitet
Långtidsstudier på djur har inte utförts för att utvärdera den karcinogena potentialen hos klobetasolpropionat.
Studier på råtta efter subkutan administrering vid dosnivåer upp till 50 mcg/kg/dag visade att honorna uppvisade en ökning av antalet resorberade embryon och en minskning av antalet levande foster vid den högsta dosen.
Klobetasolpropionat var icke-mutagent i tre olika testsystem: Ames-testet, Saccharomyces cerevisiae-genomvandlingsanalysen och E. coli B WP2-fluktuationstestet.
Graviditet
Teratogena effekter
Graviditetskategori C. Kortikosteroider har visat sig vara teratogena hos laboratoriedjur när de administreras systemiskt i relativt låga dosnivåer. Vissa kortikosteroider har visat sig vara teratogena efter dermal applicering på laboratoriedjur.
Klobetasolpropionat har inte testats för teratogenicitet när det appliceras lokalt; det absorberas emellertid perkutant, och när det administreras subkutant var det en signifikant teratogen hos både kanin och mus. Klobetasolpropionat har större teratogen potential än steroider som är mindre potenta.
Teratogenicitetsstudier på möss som användes subkutant resulterade i fostertoxicitet vid den högsta testade dosen (1 mg/kg) och teratogenicitet vid alla testade dosnivåer ner till 0,03 mg/kg. Dessa doser är cirka 1,4 respektive 0,04 gånger den humana topikala dosen av TEMOVATE® Cream and Ointment. Abnormaliteter som sågs inkluderar gomspalt och skelettavvikelser.
Hos kaniner var klobetasolpropionat teratogent vid doser på 3 och 10 mcg/kg. Dessa doser är cirka 0,02 respektive 0,05 gånger den humana topikale dosen av TEMOVATE® Cream and Ointment. Abnormaliteter som sågs inkluderar gomspalt, kranioschisis och andra skelettavvikelser.
Det finns inga adekvata och välkontrollerade studier av den teratogena potentialen hos klobetasolpropionat hos gravida kvinnor. TEMOVATE® Cream and Ointment ska endast användas under graviditet om den potentiella nyttan motiverar den potentiella risken för fostret.
Ammande mödrar
Systemiskt administrerade kortikosteroider förekommer i bröstmjölk och kan undertrycka tillväxten, störa endogen kortikosteroidproduktion eller orsaka andra ogynnsamma effekter. Det är inte känt om topikal administrering av kortikosteroider kan resultera i tillräcklig systemisk absorption för att producera detekterbara mängder i bröstmjölk. Eftersom många läkemedel utsöndras i bröstmjölk, bör försiktighet iakttas när TEMOVATE® kräm eller salva administreras till en ammande kvinna.
Pediatrisk användning
Säkerhet och effektivitet för TEMOVATE® kräm och salva hos pediatriska patienter har inte fastställts. Användning till pediatriska patienter under 12 år rekommenderas inte. På grund av ett högre förhållande mellan hudyta och kroppsmassa löper pediatriska patienter en större risk än vuxna att drabbas av HPA-axelsuppression och Cushings syndrom när de behandlas med topikala kortikosteroider. De löper därför också större risk för binjurebarksvikt under eller efter avbrytande av behandlingen. Biverkningar inklusive striae har rapporterats vid olämplig användning av topikala kortikosteroider hos spädbarn och barn.
HPA-axelsuppression, Cushings syndrom, linjär tillväxthämning, fördröjd viktökning och intrakraniell hypertoni har rapporterats hos barn som får topikala kortikosteroider. Manifestationer av binjuresuppression hos barn inkluderar låga plasmakortisolnivåer och frånvaro av svar på ACTH-stimulering. Manifestationer av intrakraniell hypertoni inkluderar utbuktande fontaneller, huvudvärk och bilateralt papillödem.
Geriatrisk användning
Ett begränsat antal patienter vid eller över 65 år har behandlats med TEMOVATE® Cream (n = 231) och med TEMOVATE® Ointment (n = 101) i amerikanska och icke-amerikanska kliniska prövningar. Även om antalet patienter är för litet för att tillåta separat analys av effekt och säkerhet, liknade de biverkningar som rapporterades i denna population de som rapporterades av yngre patienter. Baserat på tillgängliga data är ingen justering av dosen av TEMOVATE® kräm och salva till geriatriska patienter berättigad.
ÖVERDOS
Topiskt applicerad TEMOVATE® kräm och salva kan absorberas i tillräckliga mängder för att ge systemiska effekter (se FÖRSIKTIGHETSÅTGÄRDER ).
KONTRAINDIKATIONER
TEMOVATE® (klobetasolpropionatkräm och salva) Kräm och salva, 0,05 % är kontraindicerade hos patienter med en historia av överkänslighet mot någon av komponenterna i preparaten.
KLINISK FARMAKOLOGI
Liksom andra topikala kortikosteroider har klobetasolpropionat antiinflammatoriska, klådstillande och vasokonstriktiva egenskaper. Mekanismen för den antiinflammatoriska aktiviteten hos topikala steroider är i allmänhet oklar. Kortikosteroider tros emellertid verka genom induktion av fosfolipas A2-hämmande proteiner, gemensamt kallade lipokortiner. Det antas att dessa proteiner kontrollerar biosyntesen av potenta mediatorer av inflammation såsom prostaglandiner och leukotriener genom att hämma frisättningen av deras vanliga prekursor, arakidonsyra. Arakidonsyra frisätts från membranfosfolipider av fosfolipas A2.
Farmakokinetik
Omfattningen av perkutan absorption av topikala kortikosteroider bestäms av många faktorer, inklusive vehikeln och integriteten hos den epidermala barriären. Ocklusiva förband med hydrokortison i upp till 24 timmar har inte visats öka penetrationen; dock ökar ocklusion av hydrokortison under 96 timmar markant penetrationen. Topikala kortikosteroider kan absorberas från normal intakt hud. Inflammation och/eller andra sjukdomsprocesser i huden kan öka perkutan absorption.
Studier gjorda med TEMOVATE® kräm och salva indikerar att de är i den superhöga styrkan jämfört med andra topikala kortikosteroider.
PATIENTINFORMATION
Patienter som använder topikala kortikosteroider bör få följande information och instruktioner:
