Dostinex 0.25mg, 0.5mg Cabergoline Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Dostinex 0,25 mg och hur används det?
Dostinex (kabergolin) är en dopaminreceptorantagonist som används för att behandla en hormonobalans där det finns för mycket prolaktin i blodet (kallas även hyperprolaktinemi).
Vilka är biverkningarna av Dostinex?
Vanliga biverkningar av Dostinex 0,25 mg inkluderar:
- illamående,
- kräkningar,
- magbesvär eller smärta,
- dålig matsmältning,
- förstoppning,
- gas,
- yrsel,
- snurrande känsla,
- yrsel,
- dåsighet,
- nervositet,
- trötthet,
- huvudvärk,
- deppigt humör,
- värmevallningar,
- domningar eller stickningar, eller
- torr mun.
Tala om för din läkare om du upplever sällsynta men allvarliga biverkningar av Dostinex inklusive:
- andnöd,
- envis hosta,
- svullna anklar eller fötter,
- ovanlig trötthet,
- mentala/humörsförändringar (som nervositet),
- ovanligt starka drifter (såsom ökat spelande, ökat sexuellt behov),
- synförändringar,
- smärtsamma mens, eller
- bröstsmärtor.
BESKRIVNING
DOSTINEX tabletter innehåller kabergolin, en dopaminreceptoragonist. Det kemiska namnet för kabergolin är 1-[(6-allylergolin-8β-yl)-karbonyl]-1-[3-(dimetylamino)propyl]-3-etylurea. Dess empiriska formel är C26H37N5O2 och dess molekylvikt är 451,62. Strukturformeln är som följer:
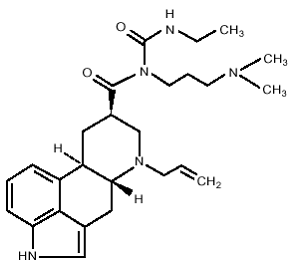
Kabergolin är ett vitt pulver lösligt i etylalkohol, kloroform och N,N-dimetylformamid (DMF); lätt löslig i 0,1 N saltsyra; mycket svagt löslig i n-hexan; och olöslig i vatten.
DOSTINEX 0,25 mg tabletter, för oral administrering, innehåller 0,5 mg kabergolin. Inaktiva ingredienser består av leucin, USP och laktos, NF.
INDIKATIONER
DOSTINEX 0,5 mg tabletter är indicerade för behandling av hyperprolaktinemiska störningar, antingen idiopatiska eller på grund av hypofysadenom.
DOSERING OCH ADMINISTRERING
Den rekommenderade dosen av DOSTINEX 0,25 mg tabletter för initiering av behandlingen är 0,25 mg två gånger i veckan. Dosen kan ökas med 0,25 mg två gånger i veckan upp till en dos på 1 mg två gånger i veckan beroende på patientens serumprolaktinnivå. Innan behandling påbörjas bör kardiovaskulär utvärdering utföras och ekokardiografi bör övervägas för att bedöma klaffsjukdom.
Dosökningar bör inte ske snabbare än var fjärde vecka, så att läkaren kan bedöma patientens svar på varje dosnivå. Om patienten inte svarar adekvat, och ingen ytterligare fördel observeras med högre doser, bör den lägsta dosen som uppnådde maximalt svar användas och andra terapeutiska metoder övervägas. Patienter som får långtidsbehandling med DOSTINEX 0,25 mg bör genomgå periodisk bedömning av sin hjärtstatus och ekokardiografi bör övervägas.
Efter att en normal serumprolaktinnivå har bibehållits i 6 månader kan DOSTINEX 0,5 mg sättas ut, med periodisk övervakning av serumprolaktinnivån för att avgöra om eller när behandlingen med DOSTINEX ska återupptas. Effektens hållbarhet utöver 24 månaders behandling med DOSTINEX har inte fastställts.
HUR LEVERERAS
DOSTINEX tabletter är vita, skårade, kapselformade tabletter som innehåller 0,5 mg kabergolin. Varje tablett har skåra på ena sidan och har bokstaven P och bokstaven U på vardera sidan av brytlinjen. Den andra sidan av tabletten är graverad med siffran 700.
DOSTINEX finns tillgänglig enligt följande:
Flaskor med 8 tabletter NDC 0013-7001-12
Lagring
Förvara i kontrollerad rumstemperatur 20° till 25°C (68° till 77°F) [se USP ].
Denna produkts etikett kan ha uppdaterats. För aktuell fullständig förskrivningsinformation, besök www.pfizer.com
Distribuerat av: Pharmacia & Upjohn Company Division of Pfizer Inc., NY, NY 10017. Reviderad: sep 2014
BIEFFEKTER
Säkerheten för DOSTINEX 0,25 mg tabletter har utvärderats hos mer än 900 patienter med hyperprolaktinemiska störningar. De flesta biverkningarna var milda eller måttliga i svårighetsgrad.
en 4-veckors, dubbelblind, placebokontrollerad studie bestod behandlingen av placebo eller kabergolin i fasta doser på 0,125, 0,5, 0,75 eller 1,0 mg två gånger i veckan. Doserna halverades under den första veckan. Eftersom en möjlig dosrelaterad effekt endast observerades för illamående, har de fyra behandlingsgrupperna för kabergolin kombinerats. Incidensen av de vanligaste biverkningarna under den placebokontrollerade studien presenteras i följande tabell.
Incidensen av rapporterade biverkningar under den 4 veckor långa, dubbelblinda, placebokontrollerade studien
Under den 8 veckor långa dubbelblinda perioden av den jämförande studien med bromokriptin avbröts DOSTINEX (vid en dos på 0,5 mg två gånger i veckan) på grund av en biverkning hos 4 av 221 patienter (2 %) medan bromokriptin (i en dos) av 2,5 mg två gånger om dagen) avbröts hos 14 av 231 patienter (6%). De vanligaste orsakerna till att behandlingen avbröts med DOSTINEX var huvudvärk, illamående och kräkningar (3, 2 respektive 2 patienter); de vanligaste orsakerna till avbrott med bromokriptin var illamående, kräkningar, huvudvärk och yrsel eller svindel (10, 3, 3 respektive 3 patienter). Incidensen av de vanligaste biverkningarna under den dubbelblinda delen av den jämförande studien med bromokriptin presenteras i följande tabell.
Incidensen av rapporterade biverkningar under den 8-veckors dubbelblinda perioden av den jämförande studien med bromokriptin
Andra biverkningar som rapporterades med en incidens på
Kroppen som helhet: ansiktsödem, influensaliknande symtom, sjukdomskänsla
Kardiovaskulära systemet: hypotoni, synkope, hjärtklappning
Matsmältningssystemet: muntorrhet, flatulens, diarré, anorexi
Metaboliskt och näringsmässigt system: viktminskning, viktökning
Nervsystem: somnolens, nervositet, parestesi, sömnlöshet, ångest
Andningssystem: nästäppa, näsblod
Hud och bihang: akne, klåda
Särskilda sinnen: onormal syn
Urogenitala systemet: dysmenorré, ökad libido
Kabergolins säkerhet har utvärderats hos cirka 1 200 patienter med Parkinsons sjukdom i kontrollerade och okontrollerade studier vid doser på upp till 11,5 mg/dag, vilket avsevärt överstiger den maximala rekommenderade dosen av kabergolin för hyperprolaktinemiska störningar. Utöver de biverkningar som inträffade hos patienter med hyperprolaktinemiska störningar, var de vanligaste biverkningarna hos patienter med Parkinsons sjukdom dyskinesi, hallucinationer, förvirring och perifert ödem. Hjärtsvikt, pleurautgjutning, lungfibros och mag- eller duodenalsår förekom sällan. Ett fall av konstriktiv perikardit har rapporterats.
Övervakningsdata efter marknadsföring
Följande händelser har rapporterats i samband med DOSTINEX: hjärtklaffpati och extrakardiella fibrotiska reaktioner, (se VARNINGAR , Hjärtvalvulopati och extrakardiella fibrotiska reaktioner ).
Andra händelser har rapporterats i samband med kabergolin: hypersexualitet, ökad libido och patologiskt spelande (se FÖRSIKTIGHETSÅTGÄRDER , Psykiatrisk ). Dessutom har fall av alopeci, aggression och psykotisk störning rapporterats hos patienter som tar DOSTINEX. Vissa av dessa rapporter har gällt patienter som tidigare haft biverkningar av dopaminagonistprodukter.
LÄKEMEDELSINTERAKTIONER
DOSTINEX 0,5 mg ska inte administreras samtidigt med D-antagonister, såsom fenotiaziner, butyrofenoner, tioxantener eller metoklopramid.
VARNINGAR
Graviditet
Dopaminagonister bör i allmänhet inte användas till patienter med graviditetsinducerad hypertoni, till exempel preeklampsi, eklampsi och post partum hypertoni, såvida inte den potentiella nyttan bedöms uppväga den möjliga risken.
Fibrotiska komplikationer
Hjärtvalvulopati
Alla patienter bör genomgå en kardiovaskulär utvärdering, inklusive ekokardiogram för att bedöma eventuell förekomst av klaffsjukdom. Om klaffsjukdom upptäcks ska patienten inte behandlas med DOSTINEX. (Ser KONTRAINDIKATIONER ) Fall av hjärtklaffpati har rapporterats efter marknadsföring hos patienter som fått DOSTINEX. Dessa fall har vanligtvis inträffat under administrering av höga doser av DOSTINEX (> 2 mg/dag) för behandling av Parkinsons sjukdom. Fall av hjärtklaffpati har också rapporterats hos patienter som fått lägre doser av DOSTINEX för behandling av hyperprolaktinemiska störningar.
En retrospektiv kohortstudie i flera länder med användning av allmänpraktik och registerkopplingssystem i Storbritannien, Italien och Nederländerna genomfördes för att bedöma sambandet mellan ny användning av dopaminagonister inklusive kabergolin (n = 27 812) för Parkinsons sjukdom och hyperprolaktinemi och hjärt valvulär regurgitation (CVR), andra fibroser och andra kardiopulmonella händelser under maximalt 12 års uppföljning. I denna studie var användningen av kabergolin bland personer med Parkinsons sjukdom associerad med en ökad risk för CVR jämfört med icke-ergot-härledda dopaminagonister (DA) och levodopa [incidensfrekvens (IR) per 10 000 personår på 68,1 (95) % konfidensintervall (KI): 37,2–115,3) för kabergolin vs. 10,0 (95 % KI: 5,2–19,4) för icke-ergot DAs och 11,3 (95 % KI: 7,2 –17,0) för levodopa]. I studieanalysen begränsad till personer med dopaminagonistbehandlad hyperprolaktinemi (n=8 386), jämfört med icke-användning (n=15 147), hade personer exponerade för kabergolin ingen förhöjd risk för CVR. Fynden med avseende på risken för CVR i samband med kabergolinbehandling för personer med Parkinsons sjukdom (ökad risk) och de med hyperprolaktinemi (ingen ökad risk) överensstämmer med fynden i andra publicerade studier.
Läkare bör använda den lägsta effektiva dosen av DOSTINEX för behandling av hyperprolaktinemiska störningar och bör regelbundet omvärdera behovet av fortsatt behandling med DOSTINEX. Efter påbörjad behandling bör klinisk och diagnostisk övervakning (till exempel lungröntgen, datortomografi och hjärtekokardiogram) utföras för att bedöma risken för hjärtklaffpati. Den rekommenderade frekvensen av rutinmässig ekokardiografisk övervakning är var 6:e till 12:e månad eller enligt klinisk indikation med närvaro av tecken och symtom som ödem, nytt blåsljud, dyspné eller kronisk hjärtsvikt.
DOSTINEX ska avbrytas om ett ekokardiogram avslöjar ny klaffuppstötning, klaffrestriktion eller klaffbladsförtjockning.
DOSTINEX ska användas med försiktighet till patienter som exponeras för andra läkemedel associerade med valvulopati.

Extrakardiella fibrotiska reaktioner
Fall av pleural, perikardiell och retroperitoneal fibros har rapporterats efter administrering av DOSTINEX. Vissa rapporter gällde patienter som tidigare behandlats med andra ergotina dopaminagonister. DOSTINEX ska inte användas till patienter med en historia av hjärt- eller extrakardiella fibrotiska sjukdomar.
Fibrotiska störningar kan ha en smygande start och patienter bör övervakas med avseende på manifestationer av progressiv fibros. Därför bör man under behandlingen uppmärksamma tecken och symtom på:
- Pleuro-lungsjukdom såsom dyspné, andnöd, ihållande hosta eller bröstsmärtor.
- Njurinsufficiens eller ureteral/abdominal vaskulär obstruktion som kan uppstå med smärta i länden/flanken och nedre extremitetsödem samt eventuella bukmassor eller ömhet som kan tyda på retroperitoneal fibros.
- Hjärtsvikt: Fall av valvulär och perikardiell fibros har ofta visat sig som hjärtsvikt. Klafffibros (och sammandragande perikardit) bör därför uteslutas om sådana symtom uppstår.
Klinisk och diagnostisk övervakning såsom erytrocytsedimentationshastighet, lungröntgen, serumkreatininmätningar och andra undersökningar bör övervägas vid baslinjen och vid behov medan patienter behandlas med DOSTINEX.
Efter diagnos av pleurautgjutning eller lungfibros rapporterades utsättningen av DOSTINEX resultera i förbättring av tecken och symtom.
FÖRSIKTIGHETSÅTGÄRDER
Allmän
Initiala doser högre än 1,0 mg kan ge ortostatisk hypotoni. Försiktighet bör iakttas när DOSTINEX administreras tillsammans med andra läkemedel som är kända för att sänka blodtrycket.
Hämning eller dämpning av laktation efter förlossningen
DOSTINEX 0,25 mg är inte indicerat för hämning eller undertryckande av fysiologisk amning. Användning av bromokriptin, en annan dopaminagonist för detta ändamål, har associerats med fall av högt blodtryck, stroke och anfall.
Nedsatt leverfunktion
Eftersom kabergolin i stor utsträckning metaboliseras av levern, bör försiktighet iakttas och noggrann övervakning iakttas vid administrering av DOSTINEX 0,5 mg till patienter med nedsatt leverfunktion.
Psykiatrisk
Patologiskt spelande, ökad libido och hypersexualitet har rapporterats hos patienter som behandlats med dopaminagonister inklusive kabergolin. Detta har i allmänhet varit reversibelt vid minskning av dosen eller avbrytande av behandlingen (se Övervakningsdata efter marknadsföring ).
Karcinogenes, Mutagenes, Nedsatt fertilitet
Karcinogenicitetsstudier utfördes på möss och råttor med kabergolin som gavs genom sondmatning i doser upp till 0,98 mg/kg/dag respektive 0,32 mg/kg/dag. Dessa doser är 7 gånger och 4 gånger den maximala rekommenderade humana dosen beräknad på kroppsyta med användning av totalt mg/m/vecka hos gnagare och mg/m/vecka för en människa på 50 kg.
Det fanns en lätt ökning av incidensen av cervikala och uterina leiomyom och uterina leiomyosarkom hos möss. Hos råttor var det en lätt ökning av maligna tumörer i livmoderhalsen och livmodern och interstitiell celladenom. Förekomsten av tumörer hos gnagare av honkön kan vara relaterad till långvarig undertryckande av prolaktinsekretion eftersom prolaktin behövs hos gnagare för att upprätthålla gulkroppen. I frånvaro av prolaktin ökar förhållandet östrogen/progesteron, vilket ökar risken för livmodertumörer. Hos manliga gnagare var minskningen av serumprolaktinnivåerna associerad med en ökning av serumluteiniserande hormon, vilket anses vara en kompenserande effekt för att upprätthålla syntesen av testikelsteroider. Eftersom dessa hormonella mekanismer tros vara artspecifika är relevansen av dessa tumörer för människor inte känd.
Den mutagena potentialen hos kabergolin utvärderades och visade sig vara negativ i ett antal in vitro-tester. Dessa tester inkluderade bakteriemutationstestet (Ames) med Salmonella typhimurium, genmutationsanalysen med Schizosaccharomyces pombe P1 och V79 kinesiska hamsterceller, DNA-skada och reparation i Saccharomyces cerevisiae D4 och kromosomavvikelser i humana lymfocyter. Kabergolin var också negativt i benmärgsmikronkärntestet hos mus.
Hos honråttor hämmade en daglig dos på 0,003 mg/kg under 2 veckor före parning och under hela parningsperioden befruktningen. Denna dos representerar cirka 1/28 av den maximala rekommenderade dosen för människa, beräknad på kroppsyta med användning av totalt mg/m/vecka hos råttor och mg/m/vecka för en människa på 50 kg.
Graviditet
Fosterskadliga effekter - Kategori B
Reproduktionsstudier har utförts med kabergolin på möss, råttor och kaniner administrerade genom sondmatning. (Flertal av den maximala rekommenderade humandosen i detta avsnitt beräknas på basis av kroppsyta med användning av totalt mg/m/vecka för djur och mg/m/vecka för en människa på 50 kg.)
Det fanns maternotoxiska effekter men inga teratogena effekter hos möss som fick kabergolin i doser upp till 8 mg/kg/dag (ungefär 55 gånger den maximala rekommenderade dosen för människa) under organogenesperioden.
En dos på 0,012 mg/kg/dag (ungefär 1/7 av den maximala rekommenderade humana dosen) under organogenesperioden hos råttor orsakade en ökning av embryofetalförluster efter implantation. Dessa förluster kan bero på de prolaktinhämmande egenskaperna hos kabergolin hos råttor. Vid dagliga doser på 0,5 mg/kg/dag (cirka 19 gånger den maximala rekommenderade humana dosen) under perioden av organogenes hos kanin, orsakade kabergolin mödratoxicitet som kännetecknas av en förlust av kroppsvikt och minskad födokonsumtion. Doser på 4 mg/kg/dag (cirka 150 gånger den maximala rekommenderade humana dosen) under organogenesperioden hos kanin orsakade en ökad förekomst av olika missbildningar. I en annan studie på kaniner observerades dock inga behandlingsrelaterade missbildningar eller embryofetotoxicitet vid doser upp till 8 mg/kg/dag (ungefär 300 gånger den maximala rekommenderade humana dosen).
Hos råttor hämmade doser högre än 0,003 mg/kg/dag (ungefär 1/28 av den maximala rekommenderade humana dosen) från 6 dagar före förlossningen och under hela laktationsperioden tillväxten och orsakade avkommans död på grund av minskad mjölksekretion.
Det finns dock inga adekvata och välkontrollerade studier på gravida kvinnor. Eftersom reproduktionsstudier på djur inte alltid förutsäger mänskligt svar, bör detta läkemedel endast användas under graviditet om det verkligen behövs.
Ammande mödrar
Det är inte känt om detta läkemedel utsöndras i modersmjölk. Eftersom många läkemedel utsöndras i bröstmjölk och på grund av risken för allvarliga biverkningar hos ammande spädbarn från kabergolin, bör ett beslut fattas om att avbryta amningen eller att avbryta läkemedlet, med hänsyn till läkemedlets betydelse för modern. Användning av DOSTINEX för hämning eller undertryckande av fysiologisk amning rekommenderas inte (se FÖRSIKTIGHETSÅTGÄRDER sektion).
Den prolaktinsänkande effekten av kabergolin tyder på att det kommer att störa laktationen. På grund av denna interferens med amning ska DOSTINEX 0,5 mg inte ges till kvinnor efter förlossningen som ammar eller planerar att amma.
Pediatrisk användning
Säkerhet och effektivitet för DOSTINEX 0,5 mg hos pediatriska patienter har inte fastställts.
Geriatrisk användning
Kliniska studier av DOSTINEX 0,5 mg inkluderade inte tillräckligt många försökspersoner i åldern 65 år och äldre för att avgöra om de svarar annorlunda än yngre patienter. Annan rapporterad klinisk erfarenhet har inte identifierat skillnader i svar mellan äldre och yngre patienter. I allmänhet bör dosval för en äldre patient vara försiktigt, vanligtvis med början i den nedre delen av doseringsintervallet, vilket återspeglar den högre frekvensen av nedsatt lever-, njur- eller hjärtfunktion, och av samtidig sjukdom eller annan läkemedelsbehandling.
ÖVERDOS
Överdosering kan förväntas ge nästäppa, synkope eller hallucinationer. Åtgärder för att stödja blodtrycket bör vidtas vid behov.
KONTRAINDIKATIONER
DOSTINEX tabletter är kontraindicerade hos patienter med:
- Okontrollerad hypertoni eller känd överkänslighet mot ergotderivat.
- Historik av hjärtklaffstörningar, som antydts av anatomiska bevis för valvulopati i valfri klaff, fastställd genom utvärdering före behandling inklusive ekokardiografisk demonstration av klaffbladsförtjockning, klaffrestriktion eller blandad klaffrestriktionsstenos. (Ser VARNINGAR )
- Anamnes med pulmonella, perikardiella eller retroperitoneala fibrotiska störningar. (Ser VARNINGAR )
KLINISK FARMAKOLOGI
Handlingsmekanism
Utsöndringen av prolaktin från den främre hypofysen är huvudsakligen under hypotalamisk hämmande kontroll, troligen utövad genom frisättning av dopamin från tuberoinfundibulära neuroner. Kabergolin är en långverkande dopaminreceptoragonist med hög affinitet för D2-receptorer. Resultaten av in vitro-studier visar att kabergolin utövar en direkt hämmande effekt på utsöndringen av prolaktin från hypofysens laktotrofer från råtta. Kabergolin minskade serumprolaktinnivåerna hos reserpiniserade råttor. Receptorbindningsstudier indikerar att kabergolin har låg affinitet för dopamin D1, α1- och α2-adrenerga och 5-HT1- och 5-HT2-serotoninreceptorer.
Kliniska studier
Den prolaktinsänkande effekten av DOSTINEX 0,25 mg visades hos hyperprolaktinemiska kvinnor i två randomiserade, dubbelblinda, jämförande studier, en med placebo och den andra med bromokriptin. I den placebokontrollerade studien (placebo n=20; kabergolin n=168) gav DOSTINEX 0,5 mg en dosrelaterad minskning av serumprolaktinnivåerna med prolaktin normaliserat efter 4 veckors behandling hos 29 %, 76 %, 74 % och 95 %. % av patienterna som fick 0,125, 0,5, 0,75 respektive 1,0 mg två gånger i veckan.
Under den 8 veckor långa dubbelblinda perioden av den jämförande studien med bromokriptin (kabergolin n=223; bromokriptin n=236 i avsiktsanalys) normaliserades prolaktin hos 77 % av patienterna som behandlades med DOSTINEX med 0,5 mg två gånger i veckan jämfört med 59 % av de som behandlades med bromokriptin vid 2,5 mg två gånger dagligen. Återställande av menstruationer inträffade hos 77 % av kvinnorna som behandlades med DOSTINEX, jämfört med 70 % av de som behandlades med bromokriptin. Bland patienter med galaktorré försvann detta symptom hos 73 % av de som behandlades med DOSTINEX jämfört med 56 % av de som behandlades med bromokriptin.
Farmakokinetik
Absorption
Efter orala engångsdoser på 0,5 mg till 1,5 mg givet till 12 friska vuxna frivilliga, observerades genomsnittliga maximala plasmanivåer på 30 till 70 pikogram (pg)/ml kabergolin inom 2 till 3 timmar. Över dosintervallet 0,5 till 7 mg verkade plasmanivåerna av kabergolin vara dosproportionella hos 12 friska vuxna frivilliga och nio vuxna parkinsonpatienter. En studie med upprepade doser på 12 friska frivilliga tyder på att steady-state-nivåer efter ett doseringsschema en gång i veckan förväntas vara dubbelt till tre gånger högre än efter en engångsdos. Den absoluta biotillgängligheten för kabergolin är okänd. En betydande del av den administrerade dosen genomgår en första-passage-effekt. Elimineringshalveringstiden för kabergolin beräknad från urindata från 12 friska försökspersoner varierade mellan 63 och 69 timmar. Den förlängda prolaktinsänkande effekten av kabergolin kan vara relaterad till dess långsamma eliminering och långa halveringstid.
Distribution
Hos djur, baserat på total radioaktivitet, har kabergolin (och/eller dess metaboliter) visat omfattande vävnadsfördelning. Radioaktiviteten i hypofysen översteg den i plasma med > 100 gånger och eliminerades med en halveringstid på cirka 60 timmar. Detta fynd överensstämmer med läkemedlets långvariga prolaktinsänkande effekt. Helkroppsautoradiografistudier på dräktiga råttor visade inget fosterupptag men höga nivåer i livmoderväggen. Betydande radioaktivitet (förälder plus metaboliter) detekterad i mjölken hos digivande råttor tyder på en potential för exponering för ammande spädbarn. Läkemedlet distribueras i stor utsträckning i hela kroppen. Kabergolin är måttligt bundet (40 % till 42 %) till humana plasmaproteiner på ett koncentrationsoberoende sätt. Samtidig dosering av mycket proteinbundna läkemedel kommer sannolikt inte att påverka dess disposition.
Ämnesomsättning
Hos både djur och människor metaboliseras kabergolin i stor utsträckning, huvudsakligen via hydrolys av acylureabindningen eller ureadelen. Cytokrom P-450-medierad metabolism verkar vara minimal. Kabergolin orsakar inte enzyminduktion och/eller hämning hos råtta. Hydrolys av acylurean eller ureadelen upphäver den prolaktinsänkande effekten av kabergolin, och viktiga metaboliter som hittills identifierats bidrar inte till den terapeutiska effekten.
Exkretion
Efter oral dosering av radioaktivt kabergolin till fem friska frivilliga utsöndrades cirka 22 % och 60 % av dosen inom 20 dagar i urinen respektive avföringen. Mindre än 4 % av dosen utsöndrades oförändrat i urinen. Nonrenal och renal clearance för kabergolin är cirka 3,2 l/min respektive 0,08 l/min. Urinutsöndringen hos hyperprolaktinemiska patienter var liknande.
Särskilda populationer
Njurinsufficiens
Farmakokinetiken för kabergolin förändrades inte hos 12 patienter med måttlig till svår njurinsufficiens enligt kreatininclearance.
Leverinsufficiens
Hos 12 patienter med mild till måttlig leverdysfunktion (Child-Pugh-poäng ≤ 10) observerades ingen effekt på genomsnittlig Cmax för kabergolin eller arean under plasmakoncentrationskurvan (AUC). Patienter med allvarlig insufficiens (Child-Pugh-poäng > 10) visar dock en avsevärd ökning av den genomsnittliga Cmax och AUC för kabergolin och kräver därför försiktighet.
Äldre
Effekten av ålder på farmakokinetiken för kabergolin har inte studerats.
Interaktion mellan mat och läkemedel
Hos 12 friska vuxna frivilliga förändrade maten inte kabergolinkinetiken.
Farmakodynamik
Dosrespons med hämning av plasmaprolaktin, insättande av maximal effekt och effektduration har dokumenterats efter enstaka kabergolindoser till friska frivilliga (0,05 till 1,5 mg) och hyperprolaktinemiska patienter (0,3 till 1 mg). Hos frivilliga var prolaktinhämning uppenbar vid doser > 0,2 mg, medan doser ≥ 0,5 mg orsakade maximal suppression hos de flesta försökspersoner. Högre doser ger prolaktinsuppression hos en större andel av försökspersonerna och med ett tidigare insättande och längre verkningstid. Hos 12 friska frivilliga resulterade 0,5, 1 och 1,5 mg doser i fullständig prolaktinhämning, med maximal effekt inom 3 timmar hos 92 % till 100 % av försökspersonerna efter 1 och 1,5 mg doserna jämfört med 50 % av försökspersonerna efter 0,5 mg dos.
Hos hyperprolaktinemiska patienter (N=51) var den maximala prolaktinminskningen efter en 0,6 mg enkeldos kabergolin jämförbar med 2,5 mg bromokriptin; varaktigheten av effekten var dock markant längre (14 dagar mot 24 timmar). Tiden till maximal effekt var kortare för bromokriptin än för kabergolin (6 timmar mot 48 timmar).
Hos 72 friska frivilliga resulterade enstaka eller flera doser (upp till 2 mg) av kabergolin i selektiv hämning av prolaktin utan någon uppenbar effekt på andra hypofyshormoner (GH, FSH, LH, ACTH och TSH) eller kortisol.
PATIENTINFORMATION
Patienter bör instrueras att meddela sin läkare om de misstänker att de är gravida, blir gravida eller tänker bli gravida under behandlingen. Ett graviditetstest bör göras om det finns misstanke om graviditet och fortsatt behandling bör diskuteras med sin läkare.
Patienter bör meddela sin läkare om de utvecklar andnöd, ihållande hosta, andningssvårigheter när de ligger ner eller svullna extremiteter.
