Xalatan 2.5ml Latanoprost Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
XALATAN® (latanoprost) Oftalmisk lösning
BESKRIVNING
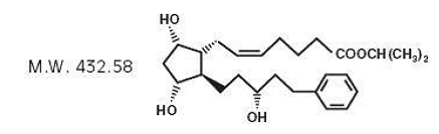
Latanoprost är en prostaglandin F2α-analog. Dess kemiska namn är isopropyl-(Z)-7[(1R,2R,3R,5S)3,5dihydroxi-2-[(3R)-3-hydroxi-5-fenylpentyl]cyklopentyl]-5-heptenoat. Dess molekylformel är C26H40O5 och dess kemiska struktur är:
Latanoprost är en färglös till svagt gul olja som är mycket löslig i acetonitril och fritt löslig i aceton, etanol, etylacetat, isopropanol, metanol och oktanol. Det är praktiskt taget olösligt i vatten.
XALATAN (latanoprost oftalmisk lösning) 0,005 % tillhandahålls som en steril, isotonisk, buffrad vattenlösning av latanoprost med ett pH på cirka 6,7 och en osmolalitet på cirka 267 mOsmol/kg. Varje ml XALATAN innehåller 50 mcg latanoprost. Bensalkoniumklorid, 0,02% tillsätts som konserveringsmedel. De inaktiva ingredienserna är: natriumklorid, natriumdivätefosfatmonohydrat, vattenfri dinatriumvätefosfat och vatten för injektionsvätskor. En droppe innehåller cirka 1,5 mikrogram latanoprost.
INDIKATIONER
XALATAN 2,5 ml är indicerat för att minska förhöjt intraokulärt tryck hos patienter med öppenvinklad glaukom eller okulär hypertoni.
DOSERING OCH ADMINISTRERING
Den rekommenderade dosen är en droppe i det/de drabbade ögat/ögonen en gång dagligen på kvällen. Om en dos glöms bort ska behandlingen fortsätta med nästa dos som vanligt.
Doseringen av XALATAN bör inte överstiga en gång dagligen; kombinerad användning av två eller flera prostaglandiner eller prostaglandinanaloger inklusive XALATAN 2,5 ml rekommenderas inte. Det har visats att administrering av dessa prostaglandinläkemedel mer än en gång dagligen kan minska den intraokulära trycksänkande effekten eller orsaka paradoxala förhöjningar av IOP.
Reduktion av IOP börjar cirka 3 till 4 timmar efter administrering och maximal effekt uppnås efter 8 till 12 timmar.
XALATAN kan användas samtidigt med andra topikala oftalmiska läkemedel för att sänka IOP. Om mer än ett topikalt oftalmiskt läkemedel används, bör läkemedlen administreras med minst fem (5) minuters mellanrum. Kontaktlinser ska tas bort före administrering av XALATAN 2,5 ml och kan sättas in igen 15 minuter efter administrering
HUR LEVERERAS
Doseringsformer och styrkor
Steril oftalmisk lösning innehållande 50 mcg/ml latanoprost.
Förvaring Och Hantering
XALATAN är en klar, isotonisk, buffrad, konserverad färglös lösning av latanoprost 0,005 % (50 mcg/ml). Den levereras som en 2,5 ml lösning i en 5 ml genomskinlig lågdensitetspolyetenflaska med en droppspets av klar polyeten, ett turkos skruvlock av polyeten med hög densitet och ett manipuleringssäkert, genomskinligt lågdensitetspolyetenlock.
2,5 ml fyllning, 0,005 % (50 mcg/ml): Paket med 1 flaska: NDC 0013-8303-04 2,5 ml fyllning, 0,005 % (50 mcg/ml): Multipack med 3 flaskor: NDC 0013-8303-01
Lagring
Skydda från ljus. Förvara oöppnad flaska/flaskor i kyl vid 2° till 8°C (36° till 46°F). Under transporten till patienten kan flaskan hållas vid temperaturer upp till 40°C (104°F) under en period som inte överstiger 8 dagar. När en flaska väl har öppnats för användning kan den förvaras i rumstemperatur upp till 25°C (77°F) i 6 veckor.
Distribueras av: Pharmacia & Upjohn Co., Division of Pfizer Inc., NY, NY 10017. Pfizer Manufacturing Belgium NV Puurs, Belgien. Reviderad: n/a
BIEFFEKTER
Följande biverkningar rapporterades efter marknadsföring och diskuteras mer i detalj i andra avsnitt av etiketten:
- Irispigmenteringsförändringar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Ögonlockets hud mörknar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Ögonfransförändringar (ökad längd, tjocklek, pigmentering och antal fransar) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Intraokulär inflammation (irit/uveit) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Makulaödem, inklusive cystoid makulaödem [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan de biverkningsfrekvenser som observerats i de kliniska studierna av ett läkemedel inte direkt jämföras med frekvenserna i de kliniska prövningarna av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i klinisk praxis.
XALATAN 2,5 ml studerades i tre multicenter, randomiserade, kontrollerade kliniska prövningar. Patienterna fick 50 mikrogram/ml XALATAN en gång dagligen eller 5 mg/ml aktiv komparator (timolol) två gånger dagligen. Patientpopulationen som studerades hade en medelålder på 65±10 år. Sju procent av patienterna avbröt före 6-månaders endpoint.
Mindre än 1 % av patienterna som behandlades med XALATAN 2,5 ml behövde avbryta behandlingen på grund av intolerans mot konjunktival hyperemi.
Okulär händelse/tecken och symtom på blefarit har identifierats som "vanligt observerade" genom analys av data från kliniska prövningar.
Erfarenhet efter marknadsföring
Följande reaktioner har identifierats efter marknadsföring av XALATAN i klinisk praxis. Eftersom de rapporteras frivilligt från en population av okänd storlek är det inte alltid möjligt att tillförlitligt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering. Reaktionerna, som har valts att inkluderas på grund av antingen deras allvarlighetsgrad, rapporteringsfrekvens, möjliga orsakssamband till XALATAN 2,5 ml, eller en kombination av dessa faktorer, inkluderar:
Störningar i nervsystemet: Yrsel; huvudvärk; giftig epidermal nekrolys
Ögonstörningar: Ögonfrans- och vellushårförändringar i ögonlocket (ökad längd, tjocklek, pigmentering och antal ögonfransar); keratit; hornhinneödem och erosioner; intraokulär inflammation (irit/uveit); makulaödem, inklusive cystoid makulaödem; trichiasis; periorbitala och ögonlocksförändringar som resulterar i fördjupning av ögonlockets sulcus; iriscysta; mörkare hud på ögonlocken; lokal hudreaktion på ögonlocken; konjunktivit; pseudopemfigoid i ögonbindhinnan
Andningsvägar, bröstkorg och mediastinum: Astma och exacerbation av astma; dyspné
Hud och subkutan vävnad: Klåda
Infektioner och angrepp: Herpes keratit
Hjärtsjukdomar: Angina; hjärtklappning; angina instabil
Allmänna störningar och villkor för administrationsplatsen: Bröstsmärta
LÄKEMEDELSINTERAKTIONER
In vitro-studier har visat att utfällning sker när ögondroppar som innehåller timerosal blandas med XALATAN. Om sådana läkemedel används ska de administreras med minst fem (5) minuters mellanrum.
Kombinerad användning av två eller flera prostaglandiner eller prostaglandinanaloger inklusive XALATAN 2,5 ml rekommenderas inte. Det har visat sig att administrering av dessa prostaglandinläkemedel mer än en gång dagligen kan minska den IOP-sänkande effekten eller orsaka paradoxala förhöjningar av IOP.
VARNINGAR
Ingår som en del av FÖRSIKTIGHETSÅTGÄRDER sektion.
FÖRSIKTIGHETSÅTGÄRDER
Pigmentering
XALATAN har rapporterats orsaka förändringar i pigmenterade vävnader. De vanligaste rapporterade förändringarna har varit ökad pigmentering av iris, periorbital vävnad (ögonlock) och ögonfransar. Pigmenteringen förväntas öka så länge som latanoprost administreras.
Pigmenteringsförändringen beror på ökat melanininnehåll i melanocyterna snarare än på en ökning av antalet melanocyter. Efter utsättning av latanoprost är pigmentering av iris sannolikt permanent, medan pigmentering av periorbital vävnad och ögonfransförändringar har rapporterats vara reversibla hos vissa patienter. Patienter som får behandling bör informeras om möjligheten till ökad pigmentering. Efter 5 år är effekterna av ökad pigmentering inte kända [se Kliniska studier ].
Irisfärgförändring kanske inte märks på flera månader till år. Vanligtvis sprids den bruna pigmenteringen runt pupillen koncentriskt mot irisens periferi och hela irisen eller delar av irisen blir mer brunaktig. Varken nevi eller fräknar i iris verkar påverkas av behandlingen. Även om behandling med XALATAN 2,5 ml kan fortsätta hos patienter som utvecklar märkbart ökad irispigmentering, bör dessa patienter undersökas regelbundet [se PATIENTINFORMATION ].
Ögonfransförändringar
XALATAN 2,5 ml kan gradvis förändra ögonfransar och vellushår i det behandlade ögat; dessa förändringar inkluderar ökad längd, tjocklek, pigmentering, antalet fransar eller hårstrån och missriktad tillväxt av ögonfransar. Ögonfransförändringar är vanligtvis reversibla vid utsättande av behandlingen [se PATIENTINFORMATION ].
Intraokulär inflammation
XALATAN 2,5 ml ska användas med försiktighet till patienter med en historia av intraokulär inflammation (irit/uveit) och bör i allmänhet inte användas till patienter med aktiv intraokulär inflammation eftersom inflammationen kan förvärras.
Makulaödem
Makulaödem, inklusive cystoid makulaödem, har rapporterats under behandling med XALATAN. XALATAN 2,5 ml ska användas med försiktighet till afatiska patienter, till pseudofaka patienter med en trasig bakre linskapsel eller till patienter med kända riskfaktorer för makulaödem.
Herpetisk keratit
Reaktivering av Herpes Simplex keratit har rapporterats under behandling med XALATAN. XALATAN 2,5 ml ska användas med försiktighet till patienter med en historia av herpetisk keratit. XALATAN 2,5 ml bör undvikas vid aktiv herpes simplex keratit eftersom inflammation kan förvärras.
Bakteriell keratit
Det har förekommit rapporter om bakteriell keratit i samband med användningen av flerdosbehållare med topikala ögonprodukter. Dessa behållare hade oavsiktligt kontaminerats av patienter som i de flesta fall hade en samtidig hornhinnesjukdom eller en störning av ögonepitelytan [se PATIENTINFORMATION ].
Använd med kontaktlinser
Kontaktlinser ska tas bort före administrering av XALATAN och kan sättas in igen 15 minuter efter administrering.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Latanoprost var inte cancerframkallande hos vare sig möss eller råttor när det administrerades genom oral sondmatning i doser på upp till 170 mikrogram/kg/dag (ungefär 2800 gånger den rekommenderade maximala humandosen) i upp till 20 respektive 24 månader.
Latanoprost var inte mutagent i bakterier, vid muslymfom eller i mikrokärntest på mus. Kromosomavvikelser observerades in vitro med humana lymfocyter. Ytterligare in vitro- och in vivo-studier på oplanerad DNA-syntes hos råttor var negativa.
Latanoprost har inte visat sig ha någon effekt på manlig eller kvinnlig fertilitet i djurstudier.
Användning i specifika populationer
Graviditet
Teratogena effekter
Graviditetskategori C.
Reproduktionsstudier har utförts på råttor och kaniner. Hos kaniner hade en incidens på 4 av 16 mödrar inga livskraftiga foster vid en dos som var ungefär 80 gånger den maximala humana dosen, och den högsta icke-embryocidala dosen hos kaniner var ungefär 15 gånger den maximala humana dosen.
Det finns inga adekvata och välkontrollerade studier på gravida kvinnor. XALATAN 2,5 ml ska endast användas under graviditet om den potentiella nyttan överväger den potentiella risken för fostret.
Ammande mödrar
Det är inte känt om detta läkemedel eller dess metaboliter utsöndras i modersmjölk. Eftersom många läkemedel utsöndras i bröstmjölk bör försiktighet iakttas när XALATAN 2,5 ml administreras till en ammande kvinna.
Pediatrisk användning
Säkerhet och effektivitet hos pediatriska patienter har inte fastställts.
Geriatrisk användning
Inga övergripande skillnader i säkerhet eller effektivitet har observerats mellan äldre och yngre patienter.
ÖVERDOS
Intravenös infusion på upp till 3 mikrogram/kg hos friska frivilliga gav genomsnittliga plasmakoncentrationer 200 gånger högre än under klinisk behandling och inga biverkningar observerades. Intravenösa doser på 5,5 till 10 mcg/kg orsakade buksmärtor, yrsel, trötthet, värmevallningar, illamående och svettning. Om överdosering med XALATAN inträffar ska behandlingen vara symptomatisk.
KONTRAINDIKATIONER
Känd överkänslighet mot latanoprost, bensalkoniumklorid eller andra ingredienser i denna produkt.
KLINISK FARMAKOLOGI
Handlingsmekanism
Latanoprost är en prostanoidselektiv FP-receptoragonist som tros minska det intraokulära trycket (IOP) genom att öka utflödet av kammarvatten. Studier på djur och människor tyder på att den huvudsakliga verkningsmekanismen är ökat uveoskleralt utflöde. Förhöjd IOP representerar en viktig riskfaktor för förlust av glaukomfält. Ju högre nivå av IOP, desto större är sannolikheten för skador på synnerven och förlust av synfältet.
Farmakodynamik
Reduktion av IOP hos människa börjar ca 3-4 timmar efter administrering och maximal effekt uppnås efter 8-12 timmar. IOP-reduktion är närvarande i minst 24 timmar.
Farmakokinetik
Absorption
Latanoprost absorberas genom hornhinnan där isopropylesterprodrugen hydrolyseras till syraform för att bli biologiskt aktiv.
Distribution
Distributionsvolymen hos människor är 0,16 ± 0,02 l/kg. Syran i latanoprost kan mätas i kammarvatten under de första 4 timmarna och i plasma endast under den första timmen efter lokal administrering. Studier på människor indikerar att toppkoncentrationen i kammarvatten uppnås cirka två timmar efter topisk administrering.
Ämnesomsättning
Latanoprost, en isopropylesterprodrug, hydrolyseras av esteraser i hornhinnan till den biologiskt aktiva syran. Den aktiva syran av latanoprost som når den systemiska cirkulationen metaboliseras primärt av levern till 1,2-dinor- och 1,2,3,4-tetranormetaboliterna via fettsyra-β-oxidation.
Exkretion
Elimineringen av syran av latanoprost från human plasma är snabb (t½ = 17 min) efter både intravenös och topikal administrering. Systemiskt clearance är cirka 7 ml/min/kg. Efter leverns β-oxidation elimineras metaboliterna huvudsakligen via njurarna. Cirka 88 % och 98 % av den administrerade dosen återvinns i urinen efter topikal respektive intravenös dosering.
Kliniska studier
Förhöjd IOP vid baslinje
Patienter med genomsnittlig baslinje-IOP på 24-25 mmHg som behandlades i 6 månader i multicenter, randomiserade, kontrollerade studier visade 6-8 mmHg-reduktioner i IOP. Denna IOP-reduktion med XALATAN 0,005 % doserat en gång dagligen motsvarade effekten av timolol 0,5 % doserat två gånger dagligen.
Progression av ökad irispigmentering
En 3-årig öppen, prospektiv säkerhetsstudie med en 2-årig förlängningsfas genomfördes för att utvärdera progressionen av ökad irispigmentering med kontinuerlig användning av XALATAN en gång dagligen som tilläggsbehandling hos 519 patienter med öppenvinklar glaukom. Analysen baserades på observerade fall av de 380 patienter som fortsatte i förlängningsfasen.
Resultaten visade att uppkomsten av märkbar ökad irispigmentering inträffade under det första behandlingsåret för majoriteten av patienterna som utvecklade märkbart ökad irispigmentering. Patienterna fortsatte att visa tecken på ökande irispigmentering under studiens fem år. Observation av ökad irispigmentering påverkade inte förekomsten, karaktären eller svårighetsgraden av biverkningar (andra än ökad irispigmentering) som registrerades i studien. IOP-reduktionen var liknande oavsett utvecklingen av ökad irispigmentering under studien.
PATIENTINFORMATION
Potential för pigmentering
Ge patienterna råd om risken för ökad brun pigmentering av iris, som kan vara permanent. Informera patienterna om risken för mörkare hud på ögonlocket, vilket kan vara reversibelt efter utsättande av XALATAN [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Potential för ögonfransförändringar
Informera patienterna om möjligheten av ögonfrans- och vellushårförändringar i det behandlade ögat under behandling med XALATAN. Dessa förändringar kan resultera i en skillnad mellan ögonen i längd, tjocklek, pigmentering, antal ögonfransar eller vellushår och/eller ögonfransarnas tillväxtriktning. Ögonfransförändringar är vanligtvis reversibla när behandlingen avbryts.
Hantera behållaren
Instruera patienterna att undvika att låta spetsen på dispenseringsbehållaren komma i kontakt med ögat eller omgivande strukturer eftersom detta kan göra att spetsen blir kontaminerad av vanliga bakterier som är kända för att orsaka ögoninfektioner. Allvarlig skada på ögat och efterföljande synförlust kan bli följden av användning av kontaminerade lösningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
När ska man söka råd från läkare
Informera patienter om att om de utvecklar ett interkurrent okulärt tillstånd (t.ex. trauma eller infektion) eller genomgår ögonkirurgi, eller utvecklar ögonreaktioner, särskilt konjunktivit och ögonlocksreaktioner, bör de omedelbart söka råd från sin läkare angående fortsatt användning av multipeldosen behållare.
Använd med kontaktlinser
Informera patienter om att XALATAN 2,5 ml innehåller bensalkoniumklorid, som kan absorberas av kontaktlinser. Kontaktlinser bör avlägsnas före administrering av lösningen. Linser kan sättas in igen 15 minuter efter administrering av XALATAN.
Använd med andra ögonläkemedel
Om mer än ett topikalt oftalmiskt läkemedel används, bör läkemedlen administreras med minst fem (5) minuters mellanrum.
