Ögondroppar: Lumigan 3ml Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Lumigan och hur används det?
Lumigan 3ml är ett receptbelagt läkemedel som används för att behandla symtom på förhöjt intraokulärt tryck orsakat av vissa typer av glaukom och hypotrikos i ögonfransarna. Lumigan kan användas ensamt eller tillsammans med andra läkemedel.
Lumigan tillhör en klass av läkemedel som kallas antiglaukom, prostaglandinagonister.
Det är inte känt om Lumigan är säkert och effektivt för barn.
Vilka är de möjliga biverkningarna av Lumigan?
Lumigan kan orsaka allvarliga biverkningar inklusive:
- ögonsvullnad,
- rodnad i ögat,
- kraftigt obehag i ögat,
- skorpa eller dränering från ögat,
- synförändringar och
- röda, svullna eller kliande ögonlock
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Lumigan inkluderar:
- ögonrodnad
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Lumigan. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
LUMIGAN® (bimatoprost oftalmisk lösning) 0,03 % är en syntetisk prostamidanalog med okulär hypotensiv aktivitet. Dess kemiska namn är (Z)-7-[(1R,2R,3R,5S)-3,5-dihydroxi-2[(1E,3S)-3-hydroxi-5-fenyl-1-pentenyl]cyklopentyl]- 5-N-etylheptenamid, och dess molekylvikt är 415,58. Dess molekylformel är C25H37NO4. Dess kemiska struktur är:
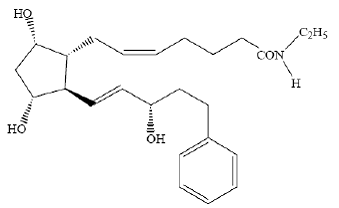
Bimatoprost är ett pulver som är mycket lösligt i etylalkohol och metylalkohol och svagt lösligt i vatten. LUMIGAN® 0,03 % är en klar, isotonisk, färglös, steril oftalmisk lösning med en osmolalitet på cirka 290 mOsmol/kg.
LUMIGAN® 0,03% innehåller Aktiva: bimatoprost 0,3 mg/ml; Inaktiva: bensalkoniumklorid 0,05 mg/ml; natriumklorid; natriumfosfat, dibasiskt; citronsyra; och renat vatten. Natriumhydroxid och/eller saltsyra kan tillsättas för att justera pH. pH under dess hållbarhet varierar från 6,8-7,8.
INDIKATIONER
LUMIGAN® (bimatoprost oftalmisk lösning) 0,01 % är indicerat för minskning av förhöjt intraokulärt tryck hos patienter med öppenvinkelglaukom eller okulär hypertoni.
DOSERING OCH ADMINISTRERING
Den rekommenderade dosen är en droppe i det/de drabbade ögat/ögonen en gång dagligen på kvällen. LUMIGAN® (bimatoprost oftalmisk lösning) 0,01 % bör inte administreras mer än en gång dagligen eftersom det har visats att mer frekvent administrering av prostaglandinanaloger kan minska den intraokulära trycksänkande effekten.
Sänkning av det intraokulära trycket börjar cirka 4 timmar efter den första administreringen med maximal effekt inom cirka 8 till 12 timmar.
LUMIGAN® 0,01% kan användas samtidigt med andra topikala oftalmiska läkemedel för att sänka det intraokulära trycket. Om mer än ett topikalt oftalmiskt läkemedel används, bör läkemedlen administreras med minst fem (5) minuters mellanrum.
HUR LEVERERAS
Doseringsformer och styrkor
Oftalmisk lösning innehållande bimatoprost 0,1 mg/ml.
Förvaring Och Handling
LUMIGAN® (bimatoprost oftalmisk lösning) 0,01 % levereras steril i ogenomskinliga vita lågdensitetspolyeten oftalmiska dispenserflaskor och spetsar med turkos polystyrenlock i följande storlekar:
2,5 mL fyll i en 5 mL behållare - NDC 0023-3205-03 5 mL fyll i en 10 mL behållare - NDC 0023-3205-05 7,5 mL fyll i en 10 mL behållare - NDC 0023-3205-08
Lagring: Förvara vid 2°C till 25°C (36°F till 77°F).
Efter öppnande kan LUMIGAN® 0,01% användas fram till utgångsdatumet på flaskan.
Distribuerat av: Allergan USA, Inc. Madison, NJ 07940. Reviderad: Mar 2022
BIEFFEKTER
Följande biverkningar beskrivs på andra ställen i märkningen:
- Pigmentering inklusive blefaral pigmentering och irishyperpigmentering [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Ögonfransförändringar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Intraokulär inflammation [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Makulaödem [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Överkänslighet [se KONTRAINDIKATIONER ]
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
en 12-månaders klinisk studie med bimatoprost oftalmiska lösningar 0,01 % var den vanligaste biverkningen konjunktival hyperemi (31 %). Cirka 1,6 % av patienterna avbröt behandlingen på grund av konjunktival hyperemi. Andra biverkningar (rapporterade hos 1 till 4 % av patienterna) med LUMIGAN® 0,01 % i denna studie inkluderade konjunktivalt ödem, konjunktival blödning, ögonirritation, ögonsmärta, ögonklåda, erytem i ögonlocket, klåda i ögonlocken, tillväxt av ögonfransar, hypertrikos, irritation på instillationsstället, punctate keratit, hudhyperpigmentering och synsuddighet, nedsatt.
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats under användning efter godkännande av LUMIGAN® 0,01 %. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering. Dessa reaktioner, som har valts att inkluderas på grund av antingen deras allvarlighetsgrad, rapporteringsfrekvens, möjliga orsakssamband till LUMIGAN® , eller en kombination av dessa faktorer inkluderar: astmaliknande symtom, yrsel, torra ögon, dyspné, flytningar från ögonen, ögonödem, känsla av främmande kroppar, huvudvärk, överkänslighet inklusive tecken och symtom på ögonallergi och allergisk dermatit, högt blodtryck, ökad tårbildning, periorbitala och ögonlocksförändringar inklusive fördjupning av ögonlockets sulcus och fotofobi.
LÄKEMEDELSINTERAKTIONER
Ingen information tillhandahålls
VARNINGAR
Ingår som en del av "FÖRSIKTIGHETSÅTGÄRDER" Sektion
FÖRSIKTIGHETSÅTGÄRDER
Pigmentering
Bimatoprost oftalmisk lösning har rapporterats orsaka förändringar i pigmenterade vävnader. De vanligast rapporterade förändringarna har varit ökad pigmentering av iris, periorbital vävnad (ögonlock) och ögonfransar. Pigmenteringen förväntas öka så länge som bimatoprost administreras. Pigmenteringsförändringen beror på ökat melanininnehåll i melanocyterna snarare än på en ökning av antalet melanocyter. Efter utsättning av bimatoprost är pigmentering av iris sannolikt permanent, medan pigmentering av periorbital vävnad och ögonfransförändringar har rapporterats vara reversibla hos vissa patienter. Patienter som får behandling bör informeras om möjligheten till ökad pigmentering. Långtidseffekterna av ökad pigmentering är inte kända.
Irisfärgförändring kanske inte märks på flera månader till år. Vanligtvis sprids den bruna pigmenteringen runt pupillen koncentriskt mot irisens periferi och hela irisen eller delar av irisen blir mer brunaktig. Varken nevi eller fräknar i iris verkar påverkas av behandlingen. Medan behandling med LUMIGAN® (bimatoprost oftalmisk lösning) 0,01 % kan fortsätta hos patienter som utvecklar märkbart ökad irispigmentering, bör dessa patienter undersökas regelbundet.
Ögonfransförändringar
LUMIGAN® 0,01% kan gradvis förändra ögonfransar och vellushår i det behandlade ögat. Dessa förändringar inkluderar ökad längd, tjocklek och antal fransar. Ögonfransförändringar är vanligtvis reversibla när behandlingen avbryts.
Intraokulär inflammation
Prostaglandinanaloger, inklusive bimatoprost, har rapporterats orsaka intraokulär inflammation. Dessutom, eftersom dessa produkter kan förvärra inflammation, bör försiktighet iakttas hos patienter med aktiv intraokulär inflammation (t.ex. uveit).
Makulaödem
Makulaödem, inklusive cystoid makulaödem, har rapporterats under behandling med bimatoprost oftalmisk lösning. LUMIGAN® 0,01% bör användas med försiktighet till afatiska patienter, till pseudofaka patienter med en trasig bakre linskapsel eller till patienter med kända riskfaktorer för makulaödem.
Bakteriell keratit
Det har förekommit rapporter om bakteriell keratit i samband med användningen av flerdosbehållare med topikala ögonprodukter. Dessa behållare hade oavsiktligt kontaminerats av patienter som i de flesta fall hade en samtidig hornhinnesjukdom eller en störning av ögonepitelytan.
Användning av kontaktlinser
LUMIGAN® 0,01 % innehåller bensalkoniumklorid, som kan absorberas av och orsaka missfärgning av mjuka kontaktlinser. Kontaktlinser ska tas bort före instillation av LUMIGAN® 0,01% och kan sättas in igen 15 minuter efter administrering.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Carcinogenes
Bimatoprost var inte cancerframkallande hos varken möss eller råttor när det administrerades genom oral sond under 104 veckor i doser upp till 2 mg/kg/dag respektive 1 mg/kg/dag (192 och 291 gånger den uppskattade humana systemiska exponeringen för bimatoprost 0,03 % doseras bilateralt en gång dagligen, baserat på blodets AUC-nivåer)
Mutagenes
Bimatoprost var inte mutagen eller klastogen i Ames-testet, i muslymfomtestet eller i in vivo-musmikronukleustesterna.
Nedsättning av fertilitet
Bimatoprost försämrade inte fertiliteten hos han- eller honråttor upp till doser på 0,6 mg/kg/dag (minst 103 gånger den rekommenderade humana exponeringen för bimatoprost 0,03 % doserat bilateralt en gång dagligen baserat på blodets AUC-nivåer).
Användning i specifika populationer
Graviditet
Risksammanfattning
Det finns inga adekvata och välkontrollerade studier av LUMIGAN® (bimatoprost oftalmisk lösning) 0,01 % administrering till gravida kvinnor. Det finns ingen ökning av risken för större fosterskador eller missfall baserat på erfarenhet av bimatoprost efter marknadsföring.
I embryofetala utvecklingsstudier resulterade administrering av bimatoprost till gravida möss och råttor under organogenesen i abort och tidig förlossning vid orala doser minst 33 gånger (möss) eller 94 gånger (råttor) den mänskliga exponeringen för bimatoprost 0,03 % doserat bilateralt en gång dagligen ( baserat på blodarea under kurvan [AUC] nivåer). Dessa biverkningar observerades inte vid 2,6 gånger (möss) och 47 gånger (råttor) den mänskliga exponeringen för bimatoprost 0,03 % doserat bilateralt en gång dagligen (baserat på blodets AUC-nivåer).
pre/postnatala utvecklingsstudier resulterade administrering av bimatoprost till dräktiga råttor från organogenes till slutet av laktationen i minskad dräktighetslängd och fostrets kroppsvikt, och ökad foster- och valpmortalitet vid orala doser minst 41 gånger den mänskliga systemiska exponeringen för bimatoprost 0,03 % doseras bilateralt en gång dagligen (baserat på blodets AUC-nivåer). Inga negativa effekter observerades hos råttavkommor vid exponeringar som uppskattades till 14 gånger den mänskliga exponeringen för bimatoprost 0,03 % doserat bilateralt en gång dagligen (baserat på blodets AUC-nivåer).
Eftersom reproduktionsstudier på djur inte alltid förutsäger humant svar, bör LUMIGAN® 0,01% administreras under graviditet endast om den potentiella nyttan överväger den potentiella risken för fostret.
Data
Djurdata
en studie av embryofetal utveckling på råtta observerades abort hos dräktiga råttor som administrerades bimatoprost oralt under organogenesen med 0,6 mg/kg/dag (94 gånger den humana systemiska exponeringen för bimatoprost 0,03 % doserat bilateralt en gång dagligen, baserat på AUC). No Observed Adverse Effect Level (NOAEL) för abort var 0,3 mg/kg/dag (uppskattad till 47 gånger den humana systemiska exponeringen för bimatoprost 0,03 % doserat bilateralt en gång dagligen, baserat på AUC). Inga abnormiteter observerades hos råttfoster vid doser upp till 0,6 mg/kg/dag.
en studie av embryofetal utveckling på mus observerades abort och tidig förlossning hos gravida möss som administrerades bimatoprost oralt under organogenesen i doser högre än eller lika med 0,3 mg/kg/dag (33 gånger den mänskliga systemiska exponeringen för bimatoprost 0,03 % doserat bilateralt en gång dagligen, baserat på AUC). NOAEL för abort och tidig förlossning var 0,1 mg/kg/dag (2,6 gånger den humana systemiska exponeringen för bimatoprost 0,03 % doserat bilateralt en gång dagligen, baserat på AUC). Inga abnormiteter observerades hos mössfoster vid doser upp till 0,6 mg/kg/dag (72 gånger den humana systemiska exponeringen för bimatoprost 0,03 % doserat bilateralt en gång dagligen, baserat på AUC).
en pre/postnatal utvecklingsstudie resulterade behandling av dräktiga råttor med bimatoprost oralt från dräktighetsdag 7 till laktationsdag 20 i minskad dräktighetslängd, ökade sena resorptioner, fosterdöd och postnatal ungdödlighet och minskad kroppsvikt hos valparna vid doser större än eller lika med 0,3 mg/kg/dag. Dessa effekter observerades vid exponeringar som var minst 41 gånger den humana systemiska exponeringen för bimatoprost 0,03 % doserat bilateralt en gång dagligen, baserat på AUC. NOAEL för postnatal utveckling och parningsprestanda hos avkomman var 0,1 mg/kg/dag (uppskattad till 14 gånger den humana systemiska exponeringen för bimatoprost 0,03 % doserat bilateralt en gång dagligen, baserat på AUC).
Laktation
Risksammanfattning
Det är inte känt om topikal okulär behandling med LUMIGAN® 0,01 % kan resultera i tillräcklig systemisk absorption för att producera påvisbara mängder i bröstmjölk. I djurstudier har bimatoprost visats vara närvarande i bröstmjölk hos lakterande råttor i en intravenös dos (dvs. 1 mg/kg) 970 gånger RHOD (på mg/rn 2-basis), dock finns inga djurdata tillgängliga vid kliniskt relevanta doser.
Utvecklings- och hälsofördelarna med amning bör beaktas tillsammans med moderns kliniska behov av LUMIGAN® 0,01 % och eventuella negativa effekter på det ammade barnet från LUMIGAN® 0,01 %.
Pediatrisk användning
Användning till pediatriska patienter under 16 år rekommenderas inte på grund av potentiella säkerhetsproblem relaterade till ökad pigmentering efter långvarig kronisk användning.
Geriatrisk användning
Inga övergripande kliniska skillnader i säkerhet eller effekt har observerats mellan äldre och andra vuxna patienter.
ÖVERDOS
Ingen information finns tillgänglig om överdosering hos människor. Om överdosering med LUMIGAN® (bimatoprost oftalmisk lösning) 0,01 % inträffar, bör behandlingen vara symptomatisk.
I orala (genom sondmatning) studier på mus och råttor gav doser upp till 100 mg/kg/dag ingen toxicitet. Denna dos uttryckt som mg/m2 är minst 210 gånger högre än den oavsiktliga dosen av en flaska LUMIGAN® 0,01 % för ett barn på 10 kg.
KONTRAINDIKATIONER
LUMIGAN® 0,01% är kontraindicerat för patienter med överkänslighet mot bimatoprost eller mot något av innehållsämnena [se NEGATIVA REAKTIONER ].
KLINISK FARMAKOLOGI
Handlingsmekanism
Bimatoprost, en prostaglandinanalog, är en syntetisk strukturell analog av prostaglandin med okulär hypotensiv aktivitet. Det härmar selektivt effekterna av naturligt förekommande ämnen, prostamider. Bimatoprost tros sänka det intraokulära trycket (IOP) hos människor genom att öka utflödet av kammarvatten genom både trabekulärt nätverk och uveosklerala vägar. Förhöjd IOP utgör en viktig riskfaktor för förlust av glaukomfält. Ju högre nivå av IOP, desto större är sannolikheten för skador på synnerven och förlust av synfältet.
Farmakokinetik
Absorption
Efter att en droppe bimatoprost oftalmisk lösning 0,03 % administrerats en gång dagligen till båda ögonen hos 15 friska försökspersoner under två veckor, toppade blodkoncentrationerna inom 10 minuter efter dosering och låg under den nedre detektionsgränsen (0,025 ng/ml) hos de flesta försökspersoner inom 1,5 timmar efter dosering. Medelvärden för Cmax och AUC0-24 timmar var likartade dag 7 och 14 vid cirka 0,08 ng/mL respektive 0,09 ng•timme/ml, vilket indikerar att steady state uppnåddes under den första veckan av okulär dosering. Det fanns ingen signifikant systemisk läkemedelsackumulering över tiden.
Distribution
Bimatoprost fördelas måttligt i kroppsvävnader med en steady-state distributionsvolym på 0,67 l/kg. I humant blod finns bimatoprost huvudsakligen i plasman. Cirka 12 % av bimatoprost förblir obundet i human plasma.
Eliminering
Ämnesomsättning
Bimatoprost är den huvudsakliga cirkulerande arten i blodet när den når den systemiska cirkulationen efter okulär dosering. Bimatoprost genomgår sedan oxidation, N-deetylering och glukuronidering för att bilda en mängd olika metaboliter.
Exkretion
Efter en intravenös dos av radiomärkt bimatoprost (3,12 mikrogram/kg) till sex friska försökspersoner var den maximala blodkoncentrationen av oförändrat läkemedel 12,2 ng/ml och minskade snabbt med en halveringstid på cirka 45 minuter. Det totala blodclearancen av bimatoprost var 1,5 l/timme/kg. Upp till 67 % av den administrerade dosen utsöndrades i urinen medan 25 % av dosen återfanns i avföringen.
Kliniska studier
I en 12-månaders klinisk studie av patienter med öppenvinkelglaukom eller okulär hypertoni med en genomsnittlig baslinje-IOP på 23,5 mmHg, var den IOP-sänkande effekten av LUMIGAN® 0,01 % en gång dagligen (på kvällen) upp till 7,5 mmHg.
PATIENTINFORMATION
Potential för pigmentering
Ge patienterna råd om risken för ökad brun pigmentering av iris, som kan vara permanent. Informera också patienterna om möjligheten att ögonlockshud mörknar, vilket kan vara reversibelt efter utsättning av LUMIGAN® (bimatoprost oftalmisk lösning) 0,01 %.
Potential för ögonfransförändringar
Informera patienterna om möjligheten av ögonfrans- och vellushårförändringar i det behandlade ögat under behandling med LUMIGAN® 0,01 %. Dessa förändringar kan resultera i en skillnad mellan ögonen i längd, tjocklek, pigmentering, antal ögonfransar eller vellushår och/eller ögonfransarnas tillväxtriktning. Ögonfransförändringar är vanligtvis reversibla när behandlingen avbryts.
Hantera behållaren
Instruera patienterna att undvika att låta spetsen på dispenseringsbehållaren komma i kontakt med ögat, omgivande strukturer, fingrar eller någon annan yta för att undvika kontaminering av lösningen av vanliga bakterier som är kända för att orsaka ögoninfektioner. Allvarliga skador på ögat och efterföljande synförlust kan bli följden av användning av kontaminerade lösningar.
När ska man söka råd från läkare
Informera patienter om att om de utvecklar ett interkurrent okulärt tillstånd (t.ex. trauma eller infektion), genomgår ögonkirurgi eller utvecklar ögonreaktioner, särskilt konjunktivit och ögonlocksreaktioner, bör de omedelbart söka råd från sin läkare angående fortsatt användning av LUMIGAN® 0,01 % .
Användning av kontaktlinser
Informera patienter om att LUMIGAN® 0,01 % innehåller bensalkoniumklorid, som kan absorberas av mjuka kontaktlinser. Kontaktlinser ska tas bort före instillation av LUMIGAN® 0,01% och kan sättas in igen 15 minuter efter administrering.
Använd med andra ögonläkemedel
Informera patienterna om att om mer än ett topikalt oftalmiskt läkemedel används, bör läkemedlen administreras minst fem (5) minuter mellan appliceringarna.
